halogenación aromática electrofílica es un tipo de sustitución aromática electrofílica. Esta reacción orgánica es típica de los compuestos aromáticos y es un método muy útil para añadir sustituyentes a un sistema aromático.
Algunos tipos de compuestos aromáticos, tales como fenol, van a reaccionar sin un catalizador, pero para los derivados del benceno típicos frente a sustratos menos reactivos, es necesario un ácido de Lewis como catalizador. Entre los ácidos Lewis que actúan como catalizadores habituales tenemos al AlCl3, FeCl3, FeBr3 y ZnCl2. Estos actúan formando un gran complejo electrofílico que ataca al anillo de benceno.
Mecanismo de reacción
El mecanismo de reacción para la cloración del benceno es el misma que para la bromación del benceno. El bromuro de hierro (III) y el cloruro de hierro (III) se inactivan si reaccionan con el agua, incluyendo la humedad del aire. Por lo tanto, son generados in situ mediante la adición de limaduras de hierro al bromo o al cloro.
El mecanismo de yodación es ligeramente diferente: el yodo (I2) se trata con un agente oxidante como el ácido nítrico para obtener el yodo electrófilo (2 I+). En un estudio el reactivo de yodación fue una mezcla de yodo y ácido iódico.1
En otra serie de estudios se usó un poderoso reactivo obtenido utilizando una mezcla de yodo y yodato de potasio concentrado disuelto en ácido sulfúrico. Aquí el agente de yodación es el catión triyodo, I3+, y la base es el ion hidrogenosulfato, HSO4-. En estos estudios, fueron investigados tanto la cinética de la reacción como las condiciones de preparación de compuestos fuertemente desactivados para la yodación, como el ácido benzoico y el 3-nitrobenzotrifluoruro.2 3
La halogenación de compuestos aromáticos se diferencia de la halogenación de alquenos , que no requieren de un ácido de Lewis como catalizador. T La formación del ion arenio da como resultado una pérdida temporal de la aromaticidad, que tiene una mayor energía de activación en comparación con la formación de carbocatión en alquenos. En otras palabras, los alquenos son más reactivos y no necesitan tener debilitado el enlace Br-Br o Cl-Cl.
Ámbito de aplicación
Si el anillo contiene un sustituyente fuertemente activador como los grupos -OH, -OR o aminas, no es necesario un catalizador, por ejemplo, en la bromación del p-cresol:4
Sin embargo, si se utiliza un catalizador con exceso de bromo, a continuación, se formará un tribromuro.
La halogenación de los fenoles más rápida en disolventes polares debido a la disociación del fenol, siendo los iones fenóxido más susceptibles al ataque electrofílico ya que son más ricos en electrones.
La cloración del tolueno con cloro sin catalizador requiere un disolvente polar, tal como el ácido acético. La selectividad para el derivado orto es baja:5
En contraste, cuando el reactivo es 2-feniletilamina, es posible emplear disolventes relativamente apolares con orto- regioselectividad exclusiva, debido a la formación intermedia de una cloramina que da paso a la siguiente etapa de la reacción intramolecular.
El colorante alimenticio eritrosina pueden ser sintetizado por yodación de otro colorante llamado fluoresceína:
Esta reacción es impulsada por el hidrogenocarbonato de sodio.
halogenación es el proceso químico mediante el cual se adicionan uno o varios átomos de elementos del grupo de los halógenos (grupo 7 de la tabla periódica) a unamolécula orgánica. Una de las halogenaciones más simples es la halogenación de alcanos. En estas reacciones los átomos de hidrógeno de los alcanos resultan sustituidos total o parcialmente por átomos del grupo de los halógenos. La reacción que tiene lugar es la siguiente:
Son posibles una gran variedad de productos químicos. La composición de la mezcla de productos vendrá dada por la concentración de los reactivos y otras condiciones del medio de reacción, por ejemplo, la temperatura.
Tipos de halogenación
En una halogenación se incorpora un átomo de halógeno a una molécula. Existen descripciones más concretas que especifican el tipo de halógeno: fluoración,cloración, bromación y yodación.
En una reacción de adición de Markovnikov, un halógeno como el bromo se hace reaccionar con un alqueno que hace que el enlace π del doble enlace se rompa para dar la formación de un haloalcano con enlace sencillo. Esto hace más reactivo al hidrocarburo, y el bromo, como resultado, es un buen grupo saliente en diversas reacciones químicas tales como las reacciones de sustitución nucleofílica alifática y las reacciones de eliminación.
Existen varios tipos principales de halogenación, incluyendo:
- Halogenación radicalaria, típica de alcanos
- Halogenación de cetonas
- Halogenación electrofílica
- Reacción de adición de halógeno
Asimismo, en la deshalogenación un átomo de halógeno se elimina de una molécula como consecuencia de una reacción.
Ejemplos
- La formación de cloruro de oro (III) por cloración de oro.

Otros métodos específicos de halogenación son la reacción de Hunsdiecker (a partir de ácido carboxílico|ácidos carboxílicos) y la reacción de Sandmeyer (haluro de arilo|haluros de arilo).
- Reacción de sustitución radicalaria en alcanos: La halogenación es la reacción de sustitución de un átomo de H en un alcano para sustituirlo por un átomo de halógeno como Cl, Br, I, F. Se trata de una reacción en tres etapas: de iniciación, de propagación y de terminación.1 Generalmente transcurre bajo luz ultravioleta.
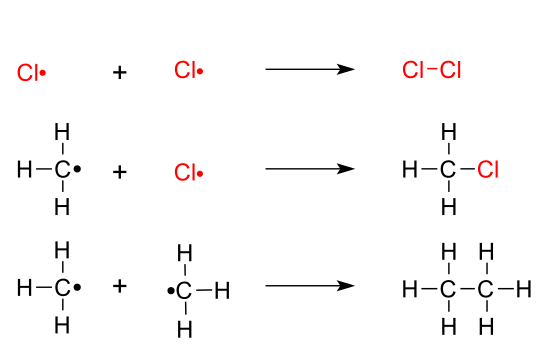
- La iniciación consiste en la formación de radicales a través de la rotura del enlace covalente. En este ejemplo, la molécula de cloro se divide en dos radicales cloro, (Cl·), cada uno de ellos con un electrón desapareado.
- En el paso 1 de la propagación se extrae un átomo como el hidrógeno de la cadena de alcano para formar un radical alquilo. El átomo de H separado se unirá al radical cloro, Cl·, formado en la etapa de iniciación.
- El paso 2 de la propagación consiste en añadir un átomo de halógeno al radical alquilo, formando un enlace covalente, por compartición de sus electrones. En este paso se forman nuevos radicales cloro, Cl·
- La terminación es donde los radicales se unen a través de reacciones de adición para formar nuevos compuestos, unidos covalentemente entre sí.
- Esto acaba con los radicales libres presentes uniéndose para impedir que continúe el mecanismo cíclico. Hay diferentes posibilidades de terminación, por lo que el resultado de esta reacción es una mezcla compleja de sustancias.
En resumen, el halógeno arranca un átomo de H de la cadena carbonada del alcano y luego se une en ese lugar a la cadena a través de una reacción de adición.
- Otro ejemplo de halogenación se puede encontrar en la síntesis orgánica del anestésico halotano a partir de tricloroetileno que implica una bromación a alta temperatura en la segunda etapa.:2
halogenación de alquenos es una reacción química en la cuál se adiciona un halógeno (generalmente Cl o Br) en cada uno de los carbonos adyacentes que se encuentran unidos por medio de un doble enlace.
Reactividad de halógenos
En las síntesis de laboratorios generalmente se utiliza bromo o cloro para producir derivados dihalogenados a partir de alquenos; el flúor es demasiado reactivo y difícil de controlar y la reactividad de yodo es muy baja, requiriendose medios altamente energéticos para su reacción.1
Mecanismo de reacción
El mecanismo de reacción moderno fue propuesto por George Kimball e Irving Roberts en 1937 y explica mediante un intermediario catión halogenonio cíclico la estereoquímica de los productos obtenidos.1 Recientemente, George Olah pudo comprobar experimentalmente la existencia del intermediario bromonio cíclico, logrando obtener soluciones estables del mismo en un medio de dióxido de azufre líquido.1
A) Formación del catión halogenonio cíclico
En el caso de bromo, el mecanismo se inicia con la adición electrofílica del bromo, generándose un intermediario de reacción catión bromonio cíclico.1
B) Ataque nucleofílico del halogenuro
Posteriormente ocurre un ataque nucleofílico del anión bromuro con estereoquímica anti en el carbono que presenta una capacidad mayor de soportar una densidad de carga positiva.1













No hay comentarios:
Publicar un comentario