Capacidad calorífica
La capacidad calorífica (C) es el puente cuantitativo que vincula el flujo de calor, desde, o hacia un sistema y el cambio de temperatura que experimenta. Si se produce un pequeño (infinitesimal) flujo de calor ΔQ se obtiene un pequeño cambio de temperatura ΔT afectado por la constante de proporcionalidad C, de modo que:
En la ecuación 1, ΔQ puede ser positivo o negativo mientras que la cantidad C es siempre positiva, de modo que el signo del cambio de temperatura indica la dirección del flujo de calor: si la temperatura aumenta el calor fluye hacia el sistema y se considera flujo positivo; si la temperatura disminuye, el calor abandona el sistema y el flujo se considera negativo.
La capacidad calorífica de un sistema es inherente al tipo de material que lo constituye y además proporcional a la cantidad de este material; y puede tener adicionalmente cierta dependencia de la temperatura.
Un cuerpo con un valor alto de la capacidad calorífica desarrolla poco cambio en la temperatura cuando se le suministra una cantidad de calor dada, o requiere de la transferencia de gran cantidad de calor para que se produzca un cambio dado en su temperatura.
Para eliminar la dependencia entre la capacidad calorífica y la cantidad de sustancia se define el calor específico (c) como la capacidad calorífica de 1 gramo de sustancia; o el calor específico molar (c') como la capacidad calorífica de un mol del material.
Las unidades de la capacidad calorífica son cal/K; las del calor específico cal/g · K y las del calor específico molar cal/mol · K.
Hemos visto que la capacidad calorífica se define en términos de un cambio pequeño (infinitesimal) de la temperatura, pero la temperatura de un sistema puede cambiar por vías diferentes en un proceso:
1.- Manteniendo la presión constante.
La capacidad calorífica con frecuencia depende de como se hace el cambio de temperatura y de los valores de las variables presión (p), volumen (V) y temperatura (T), las llamadas variables termodinámicas. De acuerdo con ello la capacidad calorífica se escribe agregando los sub-índices p o V a la representación de la capacidad calorífica (C). Los dos casos de interés especial son:
1.- Para volumen constante ΔQ = Cv ΔT
ΔQ = C ΔT (ecuación 1)
En la ecuación 1, ΔQ puede ser positivo o negativo mientras que la cantidad C es siempre positiva, de modo que el signo del cambio de temperatura indica la dirección del flujo de calor: si la temperatura aumenta el calor fluye hacia el sistema y se considera flujo positivo; si la temperatura disminuye, el calor abandona el sistema y el flujo se considera negativo.
La capacidad calorífica de un sistema es inherente al tipo de material que lo constituye y además proporcional a la cantidad de este material; y puede tener adicionalmente cierta dependencia de la temperatura.
Un cuerpo con un valor alto de la capacidad calorífica desarrolla poco cambio en la temperatura cuando se le suministra una cantidad de calor dada, o requiere de la transferencia de gran cantidad de calor para que se produzca un cambio dado en su temperatura.
Para eliminar la dependencia entre la capacidad calorífica y la cantidad de sustancia se define el calor específico (c) como la capacidad calorífica de 1 gramo de sustancia; o el calor específico molar (c') como la capacidad calorífica de un mol del material.
Las unidades de la capacidad calorífica son cal/K; las del calor específico cal/g · K y las del calor específico molar cal/mol · K.
Hemos visto que la capacidad calorífica se define en términos de un cambio pequeño (infinitesimal) de la temperatura, pero la temperatura de un sistema puede cambiar por vías diferentes en un proceso:
1.- Manteniendo la presión constante.
2.- Manteniendo el volumen constante.
3.- Con ambas magnitudes, presión y volumen cambiantes.La capacidad calorífica con frecuencia depende de como se hace el cambio de temperatura y de los valores de las variables presión (p), volumen (V) y temperatura (T), las llamadas variables termodinámicas. De acuerdo con ello la capacidad calorífica se escribe agregando los sub-índices p o V a la representación de la capacidad calorífica (C). Los dos casos de interés especial son:
1.- Para volumen constante ΔQ = Cv ΔT
2.- Para presión constante ΔQ = Cp ΔT
El cambio de volumen de los líquidos con la temperatura es insignificante comparado con el cambio que se produce en un gas y para el caso de los sólidos la presión prácticamente no tiene utilidad alguna; por lo tanto, en estos dos casos los sub-índices no se usan.
Capacidad Calorífica:
La capacidad calorífica de un cuerpo es el cociente entre la cantidad de energía calorífica transferida a un cuerpo o sistema en un proceso cualquiera y el cambio de temperatura que experimenta. En una forma menos formal es la energía necesaria para aumentar una unidad de temperatura (SI: 1 K) de una determinada sustancia, (usando el SI). Indica la mayor o menor dificultad que presenta dicho cuerpo para experimentar cambios de temperatura bajo el suministro de calor. Puede interpretarse como una medida de inercia térmica. Es una propiedad extensiva, ya que su magnitud depende, no solo de la sustancia, sino también de la cantidad de materia del cuerpo o sistema; por ello, es característica de un cuerpo o sistema particular. Por ejemplo, la capacidad calorífica del agua de una piscina olímpica será mayor que la de un vaso de agua. En general, la capacidad calorífica depende además de la temperatura y de la presión.
La capacidad calorífica de un cuerpo es el cociente entre la cantidad de energía calorífica transferida a un cuerpo o sistema en un proceso cualquiera y el cambio de temperatura que experimenta. En una forma menos formal es la energía necesaria para aumentar una unidad de temperatura (SI: 1 K) de una determinada sustancia, (usando el SI). Indica la mayor o menor dificultad que presenta dicho cuerpo para experimentar cambios de temperatura bajo el suministro de calor. Puede interpretarse como una medida de inercia térmica. Es una propiedad extensiva, ya que su magnitud depende, no solo de la sustancia, sino también de la cantidad de materia del cuerpo o sistema; por ello, es característica de un cuerpo o sistema particular. Por ejemplo, la capacidad calorífica del agua de una piscina olímpica será mayor que la de un vaso de agua. En general, la capacidad calorífica depende además de la temperatura y de la presión.
La capacidad calorífica no debe ser confundida con la capacidad calorífica específica o calor específico, el cual es la propiedad intensiva que se refiere a la capacidad de un cuerpo «para almacenar calor», y es el cociente entre la capacidad calorífica y la masa del objeto. El calor específico es una propiedad característica de las sustancias y depende de las mismas variables que la capacidad calorífica


Calor específico:
El calor específico es la cantidad de calor que se necesita por unidad de masa para elevar la temperatura un grado Celsius. La relación entre calor y cambio de temperatura, se expresa normalmente en la forma que se muestra abajo, donde c es el calor específico. Esta fórmula no se aplica si se produce un cambio de fase, porque el calor añadido o sustraído durante el cambio de fase no cambia la temperatura.
El calor específico del agua es 1 caloría/gramo °C = 4,186 julios/gramo °C que es mas alto que el de cualquier otra sustancia común. Por ello, el agua desempeña un papel muy importante en la regulación de la temperatura. El calor específico por gramo de agua es mucho mas alto que el de un metal, como se describe en el ejemplo agua-metal. En la mayoría de los casos es más significativo comparar los calores específicos molares de las sustancias.
El calor específico es la cantidad de calor que se necesita por unidad de masa para elevar la temperatura un grado Celsius. La relación entre calor y cambio de temperatura, se expresa normalmente en la forma que se muestra abajo, donde c es el calor específico. Esta fórmula no se aplica si se produce un cambio de fase, porque el calor añadido o sustraído durante el cambio de fase no cambia la temperatura.
El calor específico del agua es 1 caloría/gramo °C = 4,186 julios/gramo °C que es mas alto que el de cualquier otra sustancia común. Por ello, el agua desempeña un papel muy importante en la regulación de la temperatura. El calor específico por gramo de agua es mucho mas alto que el de un metal, como se describe en el ejemplo agua-metal. En la mayoría de los casos es más significativo comparar los calores específicos molares de las sustancias.
De acuerdo con la ley de Dulong y Petit, el calor específico molar de la mayor parte de los sólidos, a temperatura ambiente y por encima, es casi constante. A mas baja temperatura, los calores específicos caen a medida que los procesos cuánticos se hacen significativos. El comportamiento a baja temperatura se describe por el modelo Einstein-Debye para el calor específico.
El calor (representado con la letra Q) es la energía transferida de un sistema a otro (o de un sistema a sus alrededores) debido en general a una diferencia de temperatura entre ellos. El calor que absorbe o cede un sistema termodinámico depende normalmente del tipo de transformación que ha experimentado dicho sistema.
Dos o más cuerpos en contacto que se encuentran a distinta temperatura alcanzan, pasado un tiempo, el equilibrio térmico (misma temperatura). Este hecho se conoce como Principio Cero de la Termodinámica, y se ilustra en la siguiente figura.
Un aspecto del calor que conviene resaltar es que los cuerpos no almacenan calor sino energía interna. El calor es por tanto la transferencia de parte de dicha energía interna de un sistema a otro, con la condición de que ambos estén a diferente temperatura. Sus unidades en el Sistema Internacional son los julios (J)
La expresión que relaciona la cantidad de calor que intercambia una masa m de una cierta sustancia con la variación de temperatura Δt que experimenta es:
donde c es el calor específico de la sustancia.
El calor específico (o capacidad calorífica específica) es la energía necesaria para elevar en un 1 grado la temperatura de 1 kg de masa. Sus unidades en el Sistema Internacional son J/kg K.
|
En general, el calor específico de una sustancia depende de la temperatura. Sin embargo, como esta dependencia no es muy grande, suele tratarse como una constante. En esta tabla se muestra el calor específico de los distintos elementos de la tabla periódica y en esta otra el calor específico de diferentes sustancias.
Cuando se trabaja con gases es bastante habitual expresar la cantidad de sustancia en términos del número de moles n. En este caso, el calor específico se denomina capacidad calorífica molar C. El calor intercambiado viene entonces dado por:
En el Sistema Internacional, las unidades de la capacidad calorífica molar son J/molK.
- Criterio de signos: A lo largo de estas páginas, el calor absorbido por un cuerpo será positivo y el calor cedido negativo.
Capacidad calorífica de un gas ideal
Para un gas ideal se definen dos capacidades caloríficas molares: a volumen constante (CV), y a presión constante (Cp).
- CV: es la cantidad de calor que es necesario suministrar a un mol de gas ideal para elevar su temperatura un grado mediante una transformación isócora.
- Cp: es la cantidad de calor que es necesario suministrar a un mol de gas ideal para elevar su temperatura un grado mediante una transformación isóbara.
El valor de ambas capacidades caloríficas puede determinarse con ayuda de la teoría cinética de los gases ideales. Los valores respectivos para gases monoatómicos y diatómicos se encuentran en la siguiente tabla:
|
donde R es la constante universal de los gases ideales, R = 8.31 J/mol K.
Calor latente de un cambio de fase
Cuando se produce un cambio de fase, la sustancia debe absorber o ceder una cierta cantidad de calor para que tenga lugar. Este calor será positivo (absorbido) cuando el cambio de fase se produce de izquierda a derecha en la figura, y negativo (cedido) cuando la transición de fase tiene lugar de derecha a izquierda.
El calor absorbido o cedido en un cambio de fase no se traduce en un cambio de temperatura, ya que la energía suministrada o extraída de la sustancia se emplea en cambiar el estado de agregación de la materia. Este calor se denomina calor latente.
Latente en latín quiere decir escondido, y se llama así porque, al no cambiar la temperatura durante el cambio de estado, a pesar de añadir calor, éste se quedaba escondido sin traducirse en un cambio de temperatura.
Calor latente (L) o calor de cambio de estado, es la energía absorbida o cedida por unidad de masa de sustancia al cambiar de estado. De sólido a líquido este calor se denomina calor latente de fusión, de líquido a vapor calor latente de vaporización y de sólido a vapor calor latente de sublimación.
El calor latente para los procesos inversos (representados en azul en la figura anterior) tienen el mismo valor en valor absoluto, pero serán negativos porque en este caso se trata de un calor cedido.
En el Sistema Internacional, el calor latente se mide en J/kg.
La cantidad de calor que absorbe o cede una cantidad m de sustancia para cambiar de fase viene dada por:
Este calor será positivo o negativo dependiendo del cambio de fase que haya tenido lugar.
La capacidad calórica es la cantidad de calor que permite variar, en un grado, la temperatura de un cuerpo. Expresada en fórmula: 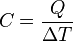 donde:
donde:  = capacidad calórica;
= capacidad calórica;  = cantidad de calor;
= cantidad de calor;  = variación de temperatura
= variación de temperatura
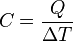 donde:
donde: 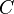 = capacidad calórica;
= capacidad calórica;  = cantidad de calor;
= cantidad de calor; 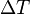 = variación de temperatura
= variación de temperatura
El calor específico es la cantidad de calor cedido o absorbido por un gramo de una sustancia, para variar su temperatura en un grado Celsius. 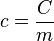 donde:
donde:  = calor específico;
= calor específico; 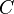 = capacidad calórica;
= capacidad calórica;  = masa
= masa
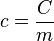 donde:
donde:  = calor específico;
= calor específico; 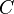 = capacidad calórica;
= capacidad calórica;  = masa
= masa
y el calor necesario para producir un cierto aumento de temperatura es

Capacidad calorífica
Como regla general, y salvo algunas excepciones puntuales, la temperatura de un cuerpo aumenta cuando se le aporta energía en forma de calor. El cociente entre la energía calorífica Q de un cuerpo y el incremento de temperatura T obtenido recibe el nombre de capacidad calorífica del cuerpo, que se expresa como:
La capacidad calorífica es un valor característico de los cuerpos, y está relacionado con otra magnitud fundamental de lacalorimetría, el calor específico.
Para elevar la temperatura de 1 g de agua en 1 ºC es necesario aportar una cantidad de calor igual a una caloría. Por tanto, la capacidad calorífica de 1 g de agua es igual a 1 cal/K.
Calor específico
El valor de la capacidad calorífica por unidad de masa se conoce como calor específico. En términos matemáticos, esta relación se expresa como:
donde c es el calor específico del cuerpo, m su masa, C la capacidad calorífica, Q el calor aportado y DT el incremento detemperatura.
El calor específico es característico para cada sustancia y, en el Sistema Internacional, se mide en julios por kilogramo y kelvin (J/(kg·K)). A título de ejemplo, el calor específico del agua es igual a:
Del estudio del calor específico del agua se obtuvo, históricamente, el valor del equivalente mecánico del calor, ya que:
Calorimetría
La determinación del calor específico de los cuerpos constituye uno de los fines primordiales de la calorimetría.
El procedimiento más habitual para medir calores específicos consiste en sumergir una cantidad del cuerpo sometido a medición en un baño de agua de temperatura conocida. Suponiendo que el sistema está aislado, cuando se alcance el equilibrio térmico se cumplirá que el calor cedido por el cuerpo será igual al absorbido por el agua, o a la inversa.
Método de medida de calores específicos. Al sumergir un cuerpo en agua de temperatura conocida, cuando se alcanza el equilibrio térmico, el calor cedido por el cuerpo es igual al absorbido por el agua.
Como la energía calorífica cedida ha de ser igual a la absorbida, se cumple que:
siendo m la masa del cuerpo sumergido, c su calor específico, T la temperatura inicial del cuerpo, ma la masa de agua, ca el calor específico del agua, Ta la temperatura inicial del agua y Tf la temperatura final de equilibrio. Todos los valores de la anterior expresión son conocidos, excepto el calor específico del cuerpo, que puede por tanto deducirse y calcularse de la misma.
Calor específico de los gases
En el caso de los gases, ha de distinguirse entre calor específico a volumen constante (cv) y a presión constante (cp). Por elprimer principio de la termodinámica, y dado que el calentamiento de un gas a volumen constante no produce trabajo, se tiene que:
En el caso particular de gases diluidos, la vinculación entre el calor específico a presión y a volumen constante sigue la llamadarelación de J. R. Mayer (1814-1878):
siendo Nm el número de moles por unidad de masa y R la constante universal de los gases perfectos.
La capacidad calorífica se puede expresar como la cantidad de calor requerida para elevar en 1ºC, la temperatura de una determinada cantidad de sustancia. Cuanto mayor sea la capacidad calorífica de una sustancia, mayor será la cantidad de calor entregada a ella para subir su temperatura. Por ejemplo, no es lo mismo calentar el agua de un vaso que el agua de toda una piscina: requerimos mayor calor para calentar el agua de toda una piscina puesto que su capacidad calorífica es mucho mayor.
La capacidad calorífica (C) (propiedad extensiva), se expresa como "calor" sobre "grados centígrados" y, por tanto, tiene las siguientes unidades:
El calor específico (c) (propiedad intensiva) tiene las siguientes unidades:
El calor específico es una propiedad intensiva, no depende de la materia, y es un valor fijo para cada sustancia. Así, el agua tiene un valor fijo de calor específico, el cual debemos entenderlo como la cantidad de calor que puede absorber una sustancia: cuanto mayor sea el calor específico, mayor cantidad de calor podrá absorber esa sustancia sin calentarse significativamente.
Según tu experiencia, de los 3 materiales anteriores (toalla, botella de plástico y lata de metal):
- ¿Cuál tendrá mayor calor específico?
- ¿Cuál tendrá menor calor específico?
La relación entre la capacidad calorífica y el calor específico está dado por:
C = m c
Ejemplo
El calor específico de agua es :
Mientras que la capacidad calorífica de 60 g de agua será:
La capacidad calorífica molar, se expresa de la siguiente manera:
Tenga en cuenta que la C de capacidad Calorífica está en mayúsculas
Cuando se añade o disminuye calor a un sistema, se produce una variación de temperatura en el sistema.
Donde:
m = masa, gramos
c = calor específico, J/g °C
Ejercicio 1.6
|
Capacidad Calorifíca de los gases
Para los gases ideales, si se determina la capacidad calorífica molar para un mismo gas a:
- volumen constante se denomina,CV
- presión constante se denomina, CP
La relación existente entre ellas está determinada por la expresión siguiente:
Donde:
- R es la constante de los gases ideales expresada en unidades de energía: .
R = 8,314 J/mol-K R = 1,989 cal/mol-K
La capacidad calorífica de los gases ideales varía, si se trata de gases monoatómicos, diatómicos y triatómicos.
La capacidad calorífica de los gases ideales varía, si se trata de gases monoatómicos, diatómicos y triatómicos.
En la tabla siguiente se muestran los valores de capacidad calorífica a volumen constante ( CV ) y a presión constante ( CP ) para gases ideales monoatómicos, diatómicos y triatómicos.
Si el sistema involucra a los gases ideales podemos expresar el calor a presión constante (qP ), como:
Recuerden que el calor a presión contante, se conoce como Entalpía (H)
Capacidades Caloríficas
| ||||||||||||||||||||||||||||||||||||||||||
|
No hay comentarios:
Publicar un comentario