Las aletrinas son un grupo de compuestos sintéticos relacionados utilizados en insecticidas . Son piretroidessintéticos , una forma sintética de un químico que se encuentra naturalmente en la flor del crisantemo . Fueron sintetizados por primera vez en los Estados Unidos por Milton S. Schechter en 1949. Allethrin fue el primer piretroide.
Se usan comúnmente en aerosoles de volumen ultra bajopara el control de mosquitos al aire libre , incluidos muchos insecticidas domésticos como el RAID , así como las bobinas para mosquitos .

Estructura química [ editar ]
La aletrina I y la aletrina II se diferencian por tener un grupo metilo y un éster metílico , respectivamente, en un extremo. Cada una de estas aletrinas consta de los ocho estereoisómeros posibles . Una variante parcialmente enantiopura de la aletrina I, que consta de solo dos estereoisómeros en una proporción aproximada de 1: 1, se llama bioaletrina . La misma mezcla de isómeros, pero en una relación aproximada de 3: 1, se conoce como esbiothrin .
Toxicidad [ editar ]
Los compuestos tienen baja toxicidad para humanos y aves. Es altamente tóxico para peces e invertebrados acuáticos. A tasas normales de aplicación, la aletrina es ligeramente tóxica para las abejas. [1] Los insectos sujetos a exposición se paralizan (efecto del sistema nervioso) antes de morir. Las aletrinas son tóxicas para los gatos [2] porque o bien no producen, o producen menos de ciertas isoformas de la glucuronosiltransferasa , que sirven en las vías del metabolismo de desintoxicación hepática.
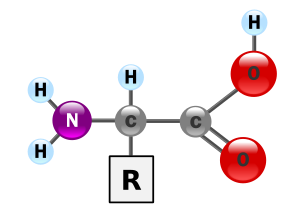
Los aminoácidos son compuestos orgánicos que contienen grupos funcionales amina (-NH 2 ) y carboxilo (-COOH) , junto con una cadena lateral (grupo R) específica para cada aminoácido. [1] [2] [3] Los elementos clave de un aminoácido son carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N), aunque otros elementos se encuentran en las cadenas laterales de ciertos aminoácidos. ácidos Se conocen alrededor de 500 aminoácidos naturales (aunque solo 20 aparecen en el código genético).) y se pueden clasificar de muchas maneras. [4] Se pueden clasificar según la ubicación de los grupos funcionales estructurales centrales como alfa- (α) , beta- (β-) , gamma- (γ-) o delta- (δ-)aminoácidos; otras categorías se relacionan con la polaridad, el nivel de pH y el tipo de grupo de cadena lateral ( alifático , acíclico , aromático , que contiene hidroxilo o azufre , etc.). En forma de proteínas , los residuos de aminoácidos forman el segundo componente más grande ( aguaEs el más grande) de los músculos humanos y otros tejidos . [5] Más allá de su papel como residuos en proteínas, los aminoácidos participan en una serie de procesos como el transporte de neurotransmisores y la biosíntesis .
En bioquímica , los aminoácidos que tienen tanto la amina como los grupos ácido carboxílico unidos al primerátomo de carbono (alfa) tienen particular importancia. Son conocidos como 2, alfa o α-aminoácidos ( fórmulagenérica H 2 NCHRCOOH en la mayoría de los casos, [6] donde R es un sustituyente orgánico conocido como " cadena lateral "); [7] a menudo el término "aminoácido" se usa para referirse específicamente a estos. Incluyen los 22 aminoácidos proteinogénicos ("construcción de proteínas"), [8] [9] [10] que se combinan para formar un péptido.cadenas ("polipéptidos") para formar los bloques de construcción de una amplia gama de proteínas . [11]Estos son todos L - estereoisómeros ( " zurdos ' isómeros ), aunque unos pocos D -aminoácidos (' mano derecha") se producen en sobres bacterianas , como un neuromodulador ( D - serina ), y en algunos antibióticos . [12]
Veinte de los aminoácidos proteinogénicos están codificados directamente por los codones tripletes en el código genético y se conocen como aminoácidos "estándar". Los otros dos ("no estándar" o "no canónico") son selenocisteína (presente en muchos procariotas y en la mayoría de los eucariotas , pero no están codificados directamente por el ADN ), y pirrolisina (que se encuentra solo en algunas arqueas y una bacteria ). La pirrolisina y la selenocisteína se codifican mediante codones variantes; por ejemplo, la selenocisteina está codificada por el codón de parada y el elemento SECIS . [13] [14] [15] NLa formilmetionina (que a menudo es el aminoácido inicial de las proteínas en bacterias, mitocondrias y cloroplastos ) generalmente se considera una forma de metionina enlugar de un aminoácido proteinogénico separado. Las combinaciones de codón- ARNt que no se encuentran en la naturaleza también se pueden usar para "expandir" el código genético y formar nuevas proteínas conocidas como aloproteínas que incorporan aminoácidos no proteinogénicos . [16] [17] [18]
Muchos aminoácidos proteogénicos y no proteogénicos importantes tienen funciones biológicas. Por ejemplo, en el cerebro humano , el glutamato ( ácido glutámico estándar ) y el ácido gamma-amino-butírico ("GABA", gamma-aminoácido no estándar) son, respectivamente, los principales neurotransmisores inhibidores e excitadores . [19] La hidroxiprolina , un componente importante del colágeno del tejido conectivo , se sintetiza a partir de la prolina . La glicina es un precursor biosintético de las porfirinas utilizadas en los glóbulos rojos . La carnitina se utiliza en el transporte de lípidos .
Los nueve aminoácidos proteinogénicos se denominan " esenciales " para los seres humanos porque el cuerpo humano no los puede producir a partir de otros compuestos y, por lo tanto, deben tomarse como alimento. Otros pueden ser condicionalmente esenciales para ciertas edades o condiciones médicas. Los aminoácidos esenciales también pueden diferir entre las especies . [20]
Debido a su importancia biológica, los aminoácidos son importantes en nutrición y se usan comúnmente en suplementos nutricionales , fertilizantes , piensos y tecnología de alimentos . Los usos industriales incluyen la producción de fármacos , plásticos biodegradables y catalizadores quirales .
Historia [ editar ]
Los primeros pocos aminoácidos fueron descubiertos a principios del siglo XIX. [21] [22] En 1806, los químicos franceses Louis-Nicolas Vauquelin y Pierre Jean Robiquet aislaron un compuesto en el espárrago que posteriormente se llamó asparagina , el primer aminoácido que se descubrió. [23] [24] La cistina se descubrió en 1810, [25] aunque su monómero, la cisteína , no se descubrió hasta 1884. [24] [26] La glicina y la leucina se descubrieron en 1820. [27] El último de los 20 amino comunes Ácidos por descubrir fuetreonina en 1935 por William Cumming Rose , quien también determinó los aminoácidos esenciales y estableció los requisitos diarios mínimos de todos los aminoácidos para un crecimiento óptimo. [28] [29]
Wurtz reconoció la unidad de la categoría química en 1865, pero no le dio ningún nombre en particular. [30] El uso del término "aminoácido" en el idioma inglés es de 1898, [31] mientras que el término alemán Aminosäure se usó anteriormente. [32] Se encontró que las proteínas producían aminoácidos después de la digestión enzimática o hidrólisis ácida . En 1902, Emil Fischer y Franz Hofmeister propusieron independientemente que las proteínas se formaran a partir de muchos aminoácidos, por lo que se forman enlaces entre el grupo amino de un aminoácido con el grupo carboxilo de otro, dando como resultado una estructura lineal que Fischer denominó " péptido ".[33]
Estructura general [ editar ]
En la estructura que se muestra en la parte superior de la página, Rrepresenta una cadena lateralespecífica para cada aminoácido. El átomo de carbono al lado del grupo carboxilo (que por lo tanto está numerado 2 en la cadena de carbono a partir de ese grupo funcional) se llama el carbono α . Los aminoácidos que contienen un grupo amino unido directamente al carbono alfa se denominan alfa-aminoácidos . [34]Estos incluyen aminoácidos como la prolina que contiene aminas secundarias , que solían denominarse "iminoácidos". [35] [36] [37]
Isomería [ editar ]
Los aminoácidos alfa son la forma más común que se encuentra en la naturaleza, pero solo cuando ocurren en el isómero L. El carbono alfa es un átomo de carbono quiral , con la excepción de la glicina, que tiene dos átomos de hidrógeno indistinguibles en el carbono alfa. [38] Por lo tanto, todos los aminoácidos alfa, excepto la glicina, pueden existir en cualquiera de dos enantiómeros , llamados aminoácidos L o D , que son imágenes especulares entre sí ( ver también Quiralidad ). Mientras que los aminoácidos L representan todos los aminoácidos que se encuentran en las proteínas durante la traducción en el ribosoma, DLos aminoácidos se encuentran en algunas proteínas producidas por modificaciones de la enzima postraduccionales después de la traducción y la translocación al retículo endoplásmico , como en organismos exóticos que habitan en el mar, como los caracoles cono . [39] También son componentes abundantes de las paredes celulares de peptidoglicano de las bacterias, [40] y la D- serina puede actuar como un neurotransmisor en el cerebro. [41] Los D- aminoácidos se utilizan en la cristalografía racémica para crear cristales centrosimétricos que (dependiendo de la proteína) pueden permitir una determinación de la estructura de la proteína más fácil y más robusta. [42] La convención L y D para la configuración de aminoácidos no se refiere a la actividad óptica del aminoácido en sí, sino a la actividad óptica del isómero del gliceraldehído a partir del cual ese aminoácido puede, en teoría, ser sintetizado ( D -gliceraldehído es dextrorotatorio ; L -gliceraldehído es levorotatorio). De manera alternativa, los designadores (S) y (R) se utilizan para indicar la estereoquímica absoluta. Casi todos los aminoácidos en las proteínas son (S) en el carbono α, siendo la cisteína (R) y la glicina no quiral . [43] La cisteína tiene su cadena lateral en la misma posición geométrica que los otros aminoácidos, pero la terminología R / S se invierte debido al mayor número atómico de azufre en comparación con el oxígeno del carboxilo que otorga a la cadena lateral una prioridad más alta, mientras que Los átomos en la mayoría de las otras cadenas laterales les dan menor prioridad.
Cadenas laterales [ editar ]
En los aminoácidos que tienen una cadena de carbono unida al carbono α (como la lisina , que se muestra a la derecha), los carbonos se marcan en orden como α, β, γ, δ, etc. [44] En algunos aminoácidos, el grupo amina está unido al carbono β o γ y, por lo tanto, se los denomina aminoácidos beta o gamma .
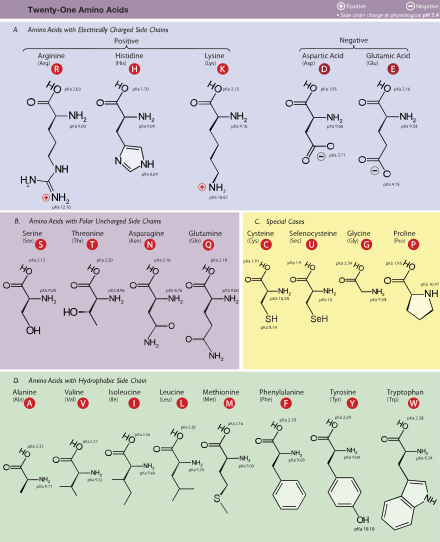
Los aminoácidos generalmente se clasifican según las propiedades de su cadena lateral en cuatro grupos. La cadena lateral puede hacer que un aminoácido sea un ácido débil o una base débil , y un hidrófilo si la cadena lateral es polar o un hidrófobo si no es polar . [38] Las estructuras químicas de los 22 aminoácidos estándar, junto con sus propiedades químicas, se describen más detalladamente en el artículo sobre estos aminoácidos proteinogénicos .
La frase " aminoácidos de cadena ramificada " o BCAA se refiere a los aminoácidos que tienen cadenas laterales alifáticas que son no lineales; Estos son leucina , isoleucina y valina . La prolina es el único aminoácido proteinogénico cuyo grupo lateral se enlaza con el grupo α-amino y, por lo tanto, también es el único aminoácido proteinogénico que contiene una amina secundaria en esta posición. [38]En términos químicos, la prolina es, por lo tanto, un iminoácido , ya que carece de un grupo amino primario , [45]aunque todavía se clasifica como un aminoácido en la nomenclatura bioquímica actual,[46] y también puede denominarse "alfa-aminoácido N-alquilado". [47]
Zwitterions [ editar ]
El grupo de aminoácidos del ácido α- carboxílico es un ácido débil , lo que significa que libera un hidrón (como un protón ) a valores de pH moderados. En otras palabras, los grupos de ácido carboxílico (−CO 2 H) pueden ser desprotonados para convertirse en carboxilatos negativos (−CO 2 - ). El ion carboxilato cargado negativamente predomina a valores de pH mayores que el pKa del grupo ácido carboxílico (la media de los 20 aminoácidos comunes es de aproximadamente 2.2, consulte la tabla de estructuras de aminoácidos más arriba). De manera complementaria, la α- amina de los aminoácidos es una base débil., lo que significa que acepta un protón a valores de pH moderados. En otras palabras, los grupos α-amino (NH 2 -) pueden protonarse para convertirse en grupos positivos de α-amonio ( + NH 3 -). El grupo α-amonio con carga positiva predomina a valores de pH menores que el pKa del grupo α-amonio (la media de los 20 α-aminoácidos comunes es de aproximadamente 9.4).
Debido a que todos los aminoácidos contienen grupos funcionales amina y ácido carboxílico, comparten propiedades anfipróticas . [38] Por debajo de pH 2.2, la forma predominante tendrá un grupo ácido carboxílico neutro y un ion α-amonio positivo (carga neta +1), y por encima de pH 9.4, un grupo carboxilato negativo y α-amino neutro (carga neta -1 ). Pero a un pH entre 2.2 y 9.4, un aminoácido usualmente contiene un grupo carboxilato negativo y un grupo positivo de α-amonio, como se muestra en la estructura (2) de la derecha, por lo que tiene una carga neta cero. Este estado molecular se conoce como zwitterion , del alemán Zwitter quesignifica "hermafrodita" o "híbrido". [48] La forma completamente neutra (estructura (1) a la izquierda) es una especie muy pequeña en solución acuosa en todo el rango de pH (menos de 1 parte en 10 7 ). Los aminoácidos existen como zwitteriones también en la fase sólida, y cristalizan con propiedades similares a la sal a diferencia de los ácidos orgánicos típicos o las aminas.
Punto isoeléctrico [ editar ]
La variación en las curvas de valoración cuando los aminoácidos se pueden agrupar por categoría. [ aclaración necesaria ] Con la excepción de la tirosina, el uso de la titulación para distinguir entre los aminoácidos hidrófobos es problemático.
A valores de pH entre los dos valores de pKa, predomina el zwitterion, pero coexiste en equilibrio dinámico con pequeñas cantidades de iones negativos netos y positivos netos. En el punto medio exacto entre los dos valores pKa, la cantidad traza del negativo neto y el rastro de los iones positivos netos se equilibran exactamente, de modo que la carga neta promedio de todas las formas presentes es cero. [49] Este pH se conoce como el punto isoeléctrico pI, por lo que pI = ½ (pKa 1 + pKa 2 ). Todos los aminoácidos individuales tienen valores de pKa ligeramente diferentes, por lo que tienen diferentes puntos isoeléctricos. Para los aminoácidos con cadenas laterales cargadas, el pKa de la cadena lateral está involucrado. Así para Asp, Glu con cadenas laterales negativas, pI = ½ (pKa 1 + pKa R), donde pKa R es la cadena lateral pKa. La cisteína también tiene una cadena lateral potencialmente negativa con pKa R = 8.14, por lo que la pI debe calcularse como Asp y Glu, aunque la cadena lateral no esté cargada significativamente a pH neutro. Para His, Lys y Arg con cadenas laterales positivas, pI = ½ (pKa R + pKa 2 ). Los aminoácidos tienen movilidad nula en la electroforesis en su punto isoeléctrico, aunque este comportamiento se explota más habitualmente para los péptidos y proteínas que para los aminoácidos simples. Los zwitteriones tienen una solubilidad mínima en su punto isoeléctrico y algunos aminoácidos (en particular, con cadenas laterales no polares) se pueden aislar por precipitación del agua ajustando el pH al punto isoeléctrico requerido.



No hay comentarios:
Publicar un comentario