La alfa -Amanitina o α-amanitina es un péptido cíclico de ochoaminoácidos . Es posiblemente el más mortal de todos losamatoxinas , toxinas encontradas en varias especies del hongogénero Amanita , uno de ellos el casquillo de la muerte ( Amanita phalloides ), así como el ángel destructor , un complejo de especies similares, principalmente A. virosa y A . bisporigera . También se encuentra en los hongos Galerina marginata y Conocybe filaris . El oral LD 50 de amanitina es de aproximadamente 0.1 mg / kg para ratas.
A diferencia de la mayoría de los péptidos cíclicos , las amatoxinas (y las falotoxinas ) se sintetizan en los ribosomas . Los genes que codifican la proproteína para α-amanitin pertenece a la misma familia que los que codifican para phallacidin (a falotoxina ).


Uso científico [ editar ]
La α-amanitina es un inhibidor selectivo de la ARN polimerasa II y III . [2] Este mecanismo lo convierte en una toxina mortal.
La α-amanitina también se puede usar para determinar qué tipos de ARN polimerasa están presentes. Esto se hace probando la sensibilidad de la polimerasa en presencia de α-amanitina. La ARN polimerasa I es insensible, la ARN polimerasa II es altamente sensible (inhibida a 1 μg / ml), la ARN polimerasa III es moderadamente sensible (inhibida a 10 μg / ml) y la ARN polimerasa IV es ligeramente sensible (inhibida a 50 μg / ml). [ cita requerida ]
Estructura química [ editar ]
La α-amanitina es un octapéptido bicíclico altamente modificado que consiste en un bucle externo e interno. El bucle externo está formado por enlaces peptídicos entre un extremo carboxilo de un aminoácido al terminal amino posterior del siguiente residuo. El bucle interior está cerrado por un enlace tryptathionine entre 6-hidroxi- triptófano y cisteína . Además, α-amanitin está decorado con modificados de aminoácidos cadenas laterales (2 S , 3 R , 4 R ) -4,5-dihidroxi isoleucina , trans -4-hidroxi- prolina , que da a su alta afinidad por ARN polimerasa II y III .[3]
Síntesis Total [ editar ]
Matinkhoo et al. ideó estrategias para superar tres obstáculos sintéticos para dar α-amanitina en 2018. [4]Primero, la síntesis enantioselectiva de la síntesis de péptidos en fase sólida compatible (2 S , 3 R , 4 R ) -4,5-dihidroxiisoleucina se proporcionó en 11 pasos a partir de 2- (benciloxi) acetaldehído. Dos pasos clave que definen la estereoquímica incluyen la crotilación marrón en las posiciones ( 3R , 4R ) y la síntesis asimétrica de aminoácidos de Strecker en el carbono ( 2S ) - α . [5]En segundo lugar, el cierre del anillo interno quimioselectivo por fluorociclización entre 6-hidroxititofano y cisteína se logró mediante la reacción intraanular de Savige-Fontana. Esto requiere una síntesis de péptidos en fase sólida compatible y ácido metiliminodiacético (MIDA), un grupo protector de boro, aminoácido ortogonal en 5 pasos. [4] Como paso final, enantioselectiva de oxidación en la vinculación tryptathionine se logró utilizando un orgánico voluminoso agente oxidante y un sistema disolvente optimizado para proporcionar el deseado la bio-reactiva ( R ) - enantiómero sulfóxido , completando la síntesis total .
Los síntomas de la intoxicación [ editar ]
La α-amanitina tiene una atracción inusualmente fuerte y específica a la enzima ARN polimerasa II. Tras la ingestión y la captación por parte de las células hepáticas, se une a la enzima ARN polimerasa II, causando eficazmente la citólisis de los hepatocitos (células hepáticas). [6] Se reportan pocos efectos dentro de las 10 horas; no es raro que aparezcan efectos significativos hasta 24 horas después de la ingestión, ya que este retraso en los síntomas hace que la intoxicación por α-amanitina sea aún más difícil de diagnosticar y aún más peligrosa. Para entonces, es mucho más allá del tiempo en que el bombeo del estómago produciría un resultado eficiente. Diarrea y calambresSon los primeros síntomas, pero esos pasan, dando una falsa señal de remisión. Normalmente, en el cuarto al quinto día, la toxina comienza a tener efectos graves en el hígado y los riñones , lo que lleva a un fallo total del sistema en ambos. La muerte usualmente ocurre alrededor de una semana desde la ingestión. [7]
Alrededor de 15% de los envenenado morirán dentro de los 10 días, progresando a través de una fase en estado de coma a insuficiencia renal , insuficiencia hepática , el coma hepático , insuficiencia respiratoria y la muerte. Aquellos que se recuperan están en riesgo de daño hepático permanente. [8] El diagnóstico es difícil, y se establece por la observación de los síntomas clínicos, así como la presencia de α-amanitina en la orina . El examen de orina generalmente es más útil dentro de las 48 horas posteriores a la ingestión. El tratamiento es principalmente de apoyo ( lavado gástrico , carbón activado , reanimación con líquidos ) pero incluye varios medicamentos para contrarrestar las amatoxinas, incluida la intravenosa.La penicilina y los derivados de la cefalosporina y, en casos de mayor ingestión, pueden extenderse a un trasplante ortotópico de hígado . El método más confiable para tratar la intoxicación por amanitina es bombear el estómago inmediatamente después de la ingestión; sin embargo, el inicio de los síntomas generalmente es demasiado tarde para que esto sea una opción. La silibinina químicamente modificada , el disibcinato disódico de silibinina dihidrógeno (nombre comercial Legalon SIL), una solución para administración IV , se utiliza en el tratamiento de intoxicaciones graves con sustancias hepatotóxicas como paracetamol y amanitinas . [9]
Modo de acción inhibitoria [ editar ]
A partir de la estructura cristalina resuelta por el Dr. Bushnell et al., [10] α-Amanitin interactúa con la hélice puente en la ARN polimerasa II (pol II). Esta interacción interfiere con la translocación del ARN y el ADN necesario para vaciar el sitio para la siguiente ronda de síntesis de ARN. La adición de α-amanitina puede reducir la tasa de transposición de pol II en el ADN de varios miles a unos pocos nucleótidos por minuto, [11] [12],pero tiene poco efecto sobre la afinidad de pol II por el trifosfato de nucleósido, [13] y Todavía se puede formar un enlace fosfodiéster. [14] [15]La hélice del puente ha evolucionado para ser flexible y su movimiento es necesario para la translocación de la polimerasa a lo largo de la columna vertebral del ADN. La unión de la α-amanitina restringe su movilidad, lo que ralentiza la translocación de la polimerasa y la velocidad de síntesis de la molécula de ARN.
El uso en conjugados anticuerpo-fármaco [ editar ]
Heidelberg Pharma, GmbH, con sede en Ladenburg , Alemania, una compañía farmacéutica que proporciona servicios de desarrollo y descubrimiento de fármacos preclínicos, ha desarrollado un nuevo conjugado anticuerpo-fármaco o tecnología ADC basada en α-amanitina. [16] Las ADC basadas en amanitina han demostrado una actividad sobresaliente en células tumorales resistentes a la terapia, por ejemplo, células que expresan transportadores resistentes a múltiples fármacos, células iniciadoras de tumores y células no divisorias en concentraciones picomolares. [dieciséis]
El modo de acción único o MOA de la α-amanitina parece hacer que los conjugados anticuerpo-fármaco a base de amanitina sean una carga útil tóxica adecuada. [17] La tolerancia y la ventana terapéutica de los ADC a base de amanitina se han determinado en una variedad de modelos de primates de roedores y no humanos. Además, la amanitina tiene una estructura soluble en agua, lo que da como resultado conjugados de anticuerpo-fármaco con baja tendencia a la agregación, incluso utilizando una relación mayor de fármaco a anticuerpo o DAR. [18] [19]
En modelos preclínicos de cáncer de próstata en ratones , la α- (alfa) -amanitina conjugada con un anticuerpo dirigido contra el antígeno de membrana específico de la próstata (PSMA; FOLH1; GCPII) mostró una alta actividad antitumoral y causó una remisión completa con dosis intravenosas únicas de 150 μg / kg. de toxina, con una pérdida de peso no más que marginal en animales tratados. Además, los conjugados de anticuerpo a base de amanitina que usan un anticuerpo anti-Her2 como el trastuzumabmostró una alta actividad antitumoral en una serie de modelos de oncología preclínica diseñados para establecer la eficacia del fármaco de prueba en el tratamiento del cáncer de mama HER2 +. La alfa-amanitina es altamente activa en células resistentes a los medicamentos, independientemente del estado de expresión de los transportadores resistentes a múltiples medicamentos debido a su estructura hidrofílica. La inhibición de la ARN polimerasa II causada por la unión de la amanitina no solo conduce a la apoptosis de las células en división, sino también a las células de crecimiento lento, que a menudo se observan en el cáncer de próstata.
La alantoína es un compuesto químico con la fórmula C 4 H 6 N 4O 3 . También se llama 5-ureidohidantoína o glioxildiureida. [1] [2] Es un diureide de ácido glioxílico . La alantoína es un intermedio metabólico importante en la mayoría de los organismos, incluidos los animales, las plantas y las bacterias. Se produce a partir del ácido úrico, que a su vez es un producto de degradación de los ácidos nucleicos , por acción de la urato oxidasa (uricasa).
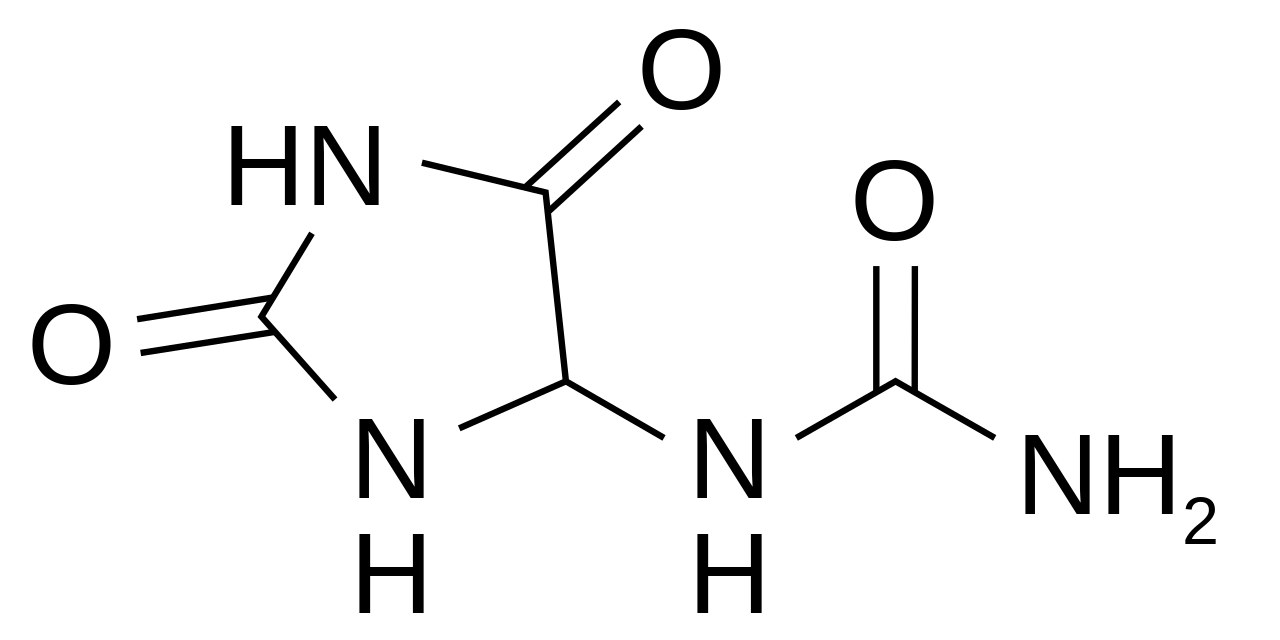
Historia [ editar ]
La alantoína fue aislada por primera vez en 1800 por el médico italiano Michele Francesco Buniva (1761–1834) y el químico francés Louis Nicolas Vauquelin , quien erróneamente creyó que estaba presente en el líquido amniótico . [6] En 1821, el químico francés Jean Louis Lassaigne lo encontró en el fluido de los alantos; lo llamó "l'acide alantoique" . [7] En 1837, los químicos alemanes Friedrich Wöhler y Justus Liebig lo sintetizaron a partir del ácido úrico y lo rebautizaron como "allantoïn". [8]
Animales [ editar ]
El nombre de la alantoides (un amniote órgano excretor embrionaria en la que se concentra durante el desarrollo en la mayoría de los mamíferos , excepto seres humanos y otros simios superiores [ vago ] ), que es un producto de oxidación de ácido úrico por purina catabolismo . Después del nacimiento, es el medio predominante por el cual los desechos nitrogenados se excretan en la orina de estos animales. [9] En humanos y otros monos superiores, la ruta metabólica para la conversión del ácido úrico en alantoína no está presente, por lo que la primera se excreta. Rasburicasarecombinantea veces se utiliza como un fármaco para catalizar esta conversión metabólica en pacientes. En los peces, la alantoína se descompone más (en amoníaco ) antes de la excreción. [10]
Se ha demostrado que la alantoína mejora la resistencia a la insulina cuando se administra a ratas y aumenta la vida útil cuando se administra al gusano nematodo Caenorhabditis elegans . [11] [12]
Bacterias [ editar ]
En bacterias, las purinas y sus derivados (como la alantoína) se utilizan como fuentes secundarias de nitrógeno en condiciones limitantes de nutrientes. Su degradación produce amoníaco, que luego puede ser utilizado. [13] Por ejemplo, Bacillus subtilis puede utilizar alantoína como su única fuente de nitrógeno. [14]
Los mutantes en el gen pucI de B. subtilis no pudieron crecer en la alantoína, lo que indica que codifica un transportador de alantoína. [15]
En Streptomyces coelicolor , la alantoinasa ( EC 3.5.2.5) y la alantoicasa (EC 3.5.3.4) son esenciales para el metabolismo de la alantoína. En esta especie, el catabolismo de la alantoína y la posterior liberación de amonio inhiben la producción de antibióticos (las especies de Streptomyces sintetizan aproximadamente la mitad de todos los antibióticos conocidos de origen microbiano). [dieciséis]
Aplicaciones [ editar ]
La alantoína está presente en extractos botánicos de la planta de consuelda y en la orina de la mayoría de los mamíferos. La alantoína a granel sintetizada químicamente, que es químicamente equivalente a la alantoína natural, es segura, no tóxica, compatible con materias primas cosméticas y cumple con los requisitos de CTFA y JSCI . Más de 10.000 patentes de referencia a la alantoína. [17]
Cosméticos y artículos de aseo [ editar ]
Los fabricantes citan varios efectos beneficiosos para la alantoína como ingrediente activo en los cosméticos de venta libre, entre ellos: un efecto hidratante y queratolítico , que aumenta el contenido de agua de la matriz extracelular y mejora la descamación de las capas superiores de las células muertas de la piel, lo que aumenta la suavidad de la piel; promoviendo la proliferación celular y la cicatrización de heridas ; y un efecto calmante, antiirritante y protector de la piel al formar complejos con agentes irritantes y sensibilizadores.
Un estudio en animales en 2010 encontró que, basándose en los resultados de los análisis histológicos , una loción suave con alantoína al 5% mejora el proceso de curación de la herida , al modular la respuesta inflamatoria . El estudio también sugiere que el análisis cuantitativo apoya la idea de que la alantoína también promueve la proliferación de fibroblastos y la síntesis de la matriz extracelular . [18]
Un estudio publicado en 2009 informó el tratamiento del prurito en la dermatitis atópica de leve a moderada con un agente tópico no esteroideo que contiene alantoína. [19]
Productos farmacéuticos [ editar ]
Con frecuencia está presente en la pasta de dientes , enjuagues bucales y en otros productos de higiene bucal , en champús , lápices labiales , productos contra el acné, productos para el cuidado del sol y lociones aclaradoras, varias lociones y cremas cosméticas y otros productos cosméticos y farmacéuticos. [20]
Biomarcador de estrés oxidativo [ editar ]
Dado que el ácido úrico es el producto final del metabolismo de las purinas en los seres humanos, solo los procesos no enzimáticos con especies reactivas de oxígeno darán lugar a la alantoína, que es un biomarcadoradecuado para medir el estrés oxidativo en las enfermedades crónicas y la senescencia .

No hay comentarios:
Publicar un comentario