Aparición y funciones en bioquímica [ editar ]
Aminoácidos proteogénicos [ editar ]
Los aminoácidos son las unidades estructurales (monómeros) que forman las proteínas. Se unen para formar cadenas poliméricas cortas llamadas péptidos o cadenas más largas llamadas polipéptidos o proteínas . Estos polímeros son lineales y no ramificados, con cada aminoácido dentro de la cadena unido a dos aminoácidos vecinos. El proceso de fabricación de proteínas codificadas por el material genético de ADN / ARN se denomina traducción e implica la adición paso a paso de aminoácidos a una cadena de proteínas en crecimiento mediante una ribozimaque se denomina ribosoma . [50] El orden en el que se agregan los aminoácidos se lee a través del código genéticode una plantilla de ARNm , que es una copia de ARN de uno de los genesdel organismo .
Veintidós aminoácidos se incorporan naturalmente a los polipéptidos y se denominan aminoácidos proteinogénicos o naturales. [38] De estos, 20 están codificados por el código genético universal . Los 2 restantes, selenocisteína y pirrolisina , se incorporan a las proteínas mediante mecanismos sintéticos únicos. La selenocisteína se incorpora cuando el ARNm que se está traduciendo incluye un elemento SECIS , que hace que el codón UGA codifique la selenocisteína en lugar de un codón de parada . [51] La pirrolisina es utilizada por algunas arqueas metanogénicas en las enzimas que utilizan para producirel metano . Está codificado con el codón UAG, que normalmente es un codón de parada en otros organismos. [52]Este codón UAG es seguido por una secuencia en sentido descendente de PYLIS . [53]
Los aminoácidos no proteinógenos [ editar ]
Aparte de los 22 aminoácidos proteinogénicos , se conocen muchos aminoácidos no proteogénicos . Esos no se encuentran en las proteínas (por ejemplo , carnitina , GABA , levotiroxina ) o no se producen directamente y de forma aislada mediante la maquinaria celular estándar (por ejemplo, hidroxiprolina y selenometionina ).
Los aminoácidos no proteogénicos que se encuentran en las proteínas se forman por modificación postraduccional , que es la modificación después de la traducción durante la síntesis de proteínas. Estas modificaciones son a menudo esenciales para la función o regulación de una proteína. Por ejemplo, la carboxilación del glutamato permite una mejor unión de los cationes de calcio , [54] y el colágeno contiene hidroxiprolina, generada por la hidroxilación de la prolina . [55] Otro ejemplo es la formación de hipusina en el factor de inicio de la traducción EIF5A, a través de la modificación de un residuo de lisina. [56] Dichas modificaciones también pueden determinar la localización de la proteína, por ejemplo, la adición de grupos hidrófobos largos puede hacer que una proteína se una a una membrana de fosfolípido . [57]
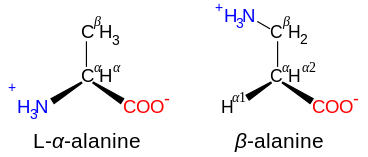
Algunos aminoácidos no proteogénicos no se encuentran en las proteínas. Los ejemplos incluyen el ácido 2-aminoisobutírico y el ácido gamma-aminobutírico neurotransmisor . Los aminoácidos no proteogénicos a menudo aparecen como intermediarios en las vías metabólicas para los aminoácidos estándar; por ejemplo, la ornitina y la citrulina se producen en el ciclo de la urea , parte del catabolismo de los aminoácidos (ver más abajo). [58] Una rara excepción al predominio de los α-aminoácidos en la biología es el β-aminoácido beta alanina (ácido 3-aminopropanoico), que se usa en plantas y microorganismos en la síntesis del ácido pantoténico (vitamina B).5 ), un componente de la coenzima A . [59]
D- aminoácido abundancia natural [ editar ]
Los D- isómeros son infrecuentes en organismos vivos. Por ejemplo, la gramicidina es un polipéptido compuesto de una mezcla de aminoácidos D y L. [60] Otros compuestos que contienen D- aminoácido son tirocidina y valinomicina . Estos compuestos alteran las paredes celulares bacterianas, particularmente en bacterias Gram-positivas . Solo 837 D- aminoácidos se encontraron en la base de datos Swiss-Prot (187 millones de aminoácidos analizados). [61]
Aminoácidos no estándar [ editar ]
Los 20 aminoácidos que están codificados directamente por los codones del código genético universal se llaman aminoácidos estándar o canónicos . Una forma modificada de metionina ( N -formilmetionina ) se incorpora a menudo en lugar de la metionina como el aminoácido inicial de las proteínas en bacterias, mitocondrias y cloroplastos. Otros aminoácidos se denominan no estándar o no canónicos . La mayoría de los aminoácidos no estándar también son no proteinogénicos (es decir, no pueden incorporarse a las proteínas durante la traducción), pero dos de ellos son proteinogénicos, ya que pueden incorporarse traduccionalmente a las proteínas al explotar información no codificada en el código genético universal. .
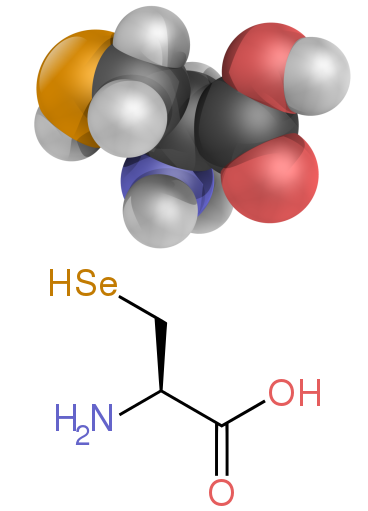
Los dos aminoácidos proteinogénicos no estándar son la selenocisteína (presente en muchos no eucariotas, así como en la mayoría de los eucariotas, pero no están codificados directamente por el ADN) y la pirrolisina (que se encuentra solo en algunas arqueas y una bacteria ). La incorporación de estos aminoácidos no estándar es rara. Por ejemplo, 25 proteínas humanas incluyen selenocisteína (Sec) en su estructura primaria, [62] y las enzimas estructuralmente caracterizadas (selenoenzimas) emplean Sec como el resto catalítico en sus sitios activos. [63] La pirrolisina y la selenocisteína se codifican mediante codones variantes. Por ejemplo, la selenocisteina está codificada por el codón de parada yElemento SECIS . [13] [14] [15]
En nutrición humana [ editar ]
Cuando se incorporan al cuerpo humano de la dieta, los 20 aminoácidos estándar se usan para sintetizar proteínas y otras biomoléculas o se oxidan a urea y dióxido de carbono como fuente de energía. [64] La vía de oxidación comienza con la eliminación del grupo amino por una transaminasa ; El grupo amino se alimenta luego en el ciclo de la urea . El otro producto de la transamidación es un ácido cetoque entra en el ciclo del ácido cítrico . [65] Losaminoácidos glucogénicos también se pueden convertir en glucosa, a través de la gluconeogénesis . [66] De los 20 aminoácidos estándar, nueve ( His, Ile , Leu , Lys , Met , Phe , Thr , Trp y Val ) son llamados aminoácidos esenciales debido a que el cuerpo humano no puede sintetizar a partir de otros compuestos en el nivel necesario para el crecimiento normal, por lo que deben obtenerse de los alimentos. [67] [68] [69] Además, cisteína , taurina , tirosina y argininase consideran aminoácidos semiesenciales en los niños (aunque la taurina no es técnicamente un aminoácido), porque las vías metabólicas que sintetizan estos aminoácidos no están completamente desarrolladas. [70] [71] Las cantidades requeridas también dependen de la edad y la salud del individuo, por lo que es difícil hacer afirmaciones generales sobre el requerimiento dietético de algunos aminoácidos. La exposición dietética al aminoácido no estándar BMAA se ha relacionado con enfermedades neurodegenerativas humanas, incluida la ELA . [72] [73]
Funciones no proteicos [ editar ]
En los seres humanos, los aminoácidos no proteicos también tienen funciones importantes como intermediarios metabólicos , como en la biosíntesis del neurotransmisor ácido gamma-amino-butírico (GABA). Muchos aminoácidos se utilizan para sintetizar otras moléculas, por ejemplo:
- El triptófano es un precursor del neurotransmisor serotonina . [80]
- La tirosina (y su fenilalanina precursora) son precursores de los neurotransmisores de catecolamina dopamina , epinefrina y norepinefrina y varias aminas traza .
- La fenilalanina es un precursor de la fenetilamina y la tirosina en los seres humanos. En las plantas, es un precursor de varios fenilpropanoides , que son importantes en el metabolismo de las plantas.
- La glicina es un precursor de las porfirinas como el hemo . [81]
- La arginina es un precursor del óxido nítrico . [82]
- La ornitina y la S-adenosilmetionina son precursores de las poliaminas . [83]
- El aspartato , la glicina y la glutamina son precursores de los nucleótidos . [84] Sin embargo, no todas las funciones de otros abundantes aminoácidos no estándar son conocidas.
Algunos aminoácidos no estándar se utilizan como defensas contra los herbívoros en las plantas. [85] Por ejemplo, la canavanina es un análogo de la arginina que se encuentra en muchas leguminosas , [86] y en cantidades particularmente grandes en Canavalia gladiata (frijol espada). [87] Este aminoácido protege a las plantas de los depredadores, como los insectos, y puede causar enfermedades en las personas si algunos tipos de leguminosas se consumen sin procesar. [88] El aminoácido no proteico mimosina se encuentra en otras especies de leguminosas, en particular Leucaena leucocephala . [89]Este compuesto es un análogo de la tirosinay puede envenenar a los animales que pastan en estas plantas.
Usos en la industria [ editar ]
Los aminoácidos se utilizan para una variedad de aplicaciones en la industria, pero su uso principal es como aditivos para la alimentación animal . Esto es necesario, ya que muchos de los componentes a granel de estos alimentos, como los frijoles de soya , tienen niveles bajos o carecen de algunos de los aminoácidos esenciales : lisina, metionina, treonina y triptófano son más importantes en la producción de estos alimentos. [90] En esta industria, los aminoácidos también se utilizan para quelar cationes metálicos con el fin de mejorar la absorción de minerales de los suplementos, que pueden ser necesarios para mejorar la salud o la producción de estos animales. [91]
La industria alimentaria también es un gran consumidor de aminoácidos, en particular, ácido glutámico , que se utiliza como un potenciador del sabor , [92] y aspartamo (aspartil-fenilalanina-1-metil éster) como un edulcorante artificial bajo en calorías . [93] Una tecnología similar a la utilizada para la nutrición animal se emplea en la industria de la nutrición humana para aliviar los síntomas de deficiencias minerales, como la anemia, al mejorar la absorción de minerales y reducir los efectos secundarios negativos de los suplementos minerales inorgánicos. [94]
La capacidad de quelación de los aminoácidos se ha utilizado en los fertilizantes para la agricultura para facilitar el suministro de minerales a las plantas con el fin de corregir las deficiencias minerales, como la clorosis de hierro. Estos fertilizantes también se utilizan para evitar que ocurran deficiencias y mejorar la salud general de las plantas. [95] La producción restante de aminoácidos se utiliza en la síntesis de fármacos y cosméticos . [90]
Del mismo modo, algunos derivados de aminoácidos se utilizan en la industria farmacéutica. Incluyen 5-HTP (5-hidroxitriptófano) utilizado para el tratamiento experimental de la depresión, [96] L -DOPA ( L- dihidroxifenilalanina) para el tratamiento del Parkinson , [97] y el medicamento con eflornitina que inhibe la ornitina descarboxilasa y se usa en el tratamiento de la enfermedad del sueño . [98]
Código genético ampliado [ editar ]
Desde 2001, se han agregado 40 aminoácidos no naturales a la proteína mediante la creación de un codón único (recodificación) y un par correspondiente de transferencia ARN: aminoacil - ARNt-sintetasa para codificarlo con diversas propiedades fisicoquímicas y biológicas con el fin de utilizarse como una herramienta para explorar la estructura y función de las proteínas o para crear proteínas nuevas o mejoradas. [16] [17]
Nullomers [ editar ]
Los nulómeros son codones que en teoría codifican un aminoácido, sin embargo, en la naturaleza existe un sesgo selectivo en contra de usar este codón en favor de otro, por ejemplo, las bacterias prefieren usar CGA en lugar de AGA para codificar arginina. [99] Esto crea algunas secuencias que no aparecen en el genoma. Esta característica puede aprovecharse y utilizarse para crear nuevos fármacos selectivos para combatir el cáncer [100] y para prevenir la contaminación cruzada de muestras de ADN en las investigaciones de la escena del crimen. [101]
Bloques de construcción químicos [ editar ]
Los aminoácidos son importantes como materias primas de bajo costo . Estos compuestos se utilizan en la síntesis de agrupaciones quirales como bloques de construcción enantioméricamente puros . [102]
Los aminoácidos se han investigado como precursores de catalizadores quirales , por ejemplo, para reacciones de hidrogenación asimétrica , aunque no existen aplicaciones comerciales. [103]
Plásticos biodegradables [ editar ]
Los aminoácidos se están desarrollando como componentes de una gama de polímeros biodegradables. Estos materiales tienen aplicaciones como embalaje ecológico y en medicina en la administración de fármacos y en la construcción de implantes protésicos . Estos polímeros incluyen polipéptidos, poliamidas , poliésteres, polisulfuros y poliuretanos con aminoácidos que forman parte de sus cadenas principales o se unen como cadenas laterales. Estas modificaciones alteran las propiedades físicas y reactividades de los polímeros. [104] Un ejemplo interesante de tales materiales es el poliaspartato , un polímero biodegradable soluble en agua que puede tener aplicaciones en pañales desechables y en la agricultura.[105] Debido a su solubilidad y la capacidad de quelar iones metálicos, poliaspartato también se está utilizando como un anti- biodegradable escalado agente y un inhibidor de la corrosión . [106] [107] Además, el aminoácido aromático tirosina se está desarrollando como un posible reemplazo de fenoles tóxicoscomo el bisfenol A en la fabricación de policarbonatos . [108]
Reacciones [ editar ]
Como los aminoácidos tienen un grupo amina primaria y un grupo carboxilo primario , estos químicos pueden sufrir la mayoría de las reacciones asociadas con estos grupos funcionales. Estos incluyen la adición nucleofílica, la formación de enlaces amida y la formación de imina para el grupo amina, y la esterificación , la formación de enlaces amida y la descarboxilación para el grupo ácido carboxílico. [109] La combinación de estos grupos funcionales permite que los aminoácidos sean ligandos polidentados eficaces para los quelatos de metal-aminoácidos. [110] Las múltiples cadenas laterales de aminoácidos también pueden sufrir reacciones químicas.[111] Los tipos de estas reacciones están determinados por los grupos en estas cadenas laterales y, por lo tanto, son diferentes entre los distintos tipos de aminoácidos.
Síntesis química [ editar ]
Existen varios métodos para sintetizar aminoácidos. Uno de los métodos más antiguos comienza con la bromación en el carbono α de un ácido carboxílico. La sustitución nucleófila con amoníacoconvierte el bromuro de alquilo en el aminoácido. [112] De manera alternativa, la síntesis de aminoácidos de Strecker implica el tratamiento de un aldehído con cianuro de potasio y amoníaco, lo que produce un α-amino nitrilo como intermedio. La hidrólisis del nitrilo en ácido produce un α-aminoácido. [113] El uso de amoniaco o sales de amonio en esta reacción proporciona aminoácidos no sustituidos, mientras que la sustitución de aminas primarias y secundarias producirá aminoácidos sustituidos.[114] Del mismo modo, el uso de cetonas , en lugar de aldehídos, da aminoácidos α, α-disustituidos. [115] La síntesis clásica proporciona mezclas racémicas de α-aminoácidos como productos, pero se han desarrollado varios procedimientos alternativos que usan auxiliares asimétricos [116] o catalizadores asimétricos [117] [118] . [119]
En el momento actual, el método más adoptado es una síntesis automatizada sobre un soporte sólido (por ejemplo, perlas de poliestireno ), utilizando grupos protectores (por ejemplo, Fmoc y t-Boc ) y grupos de activación (por ejemplo, DCC y DIC ).
Formación del enlace peptídico [ editar ]
Como tanto los grupos amino de aminoácidos como los ácidos carboxílicos pueden reaccionar para formar enlaces amida, una molécula de aminoácido puede reaccionar con otra y unirse a través de un enlace amida. Esta polimerización de aminoácidos es lo que crea proteínas. Esta reacción de condensación produce el enlace peptídico recién formado y una molécula de agua. En las células, esta reacción no ocurre directamente; en su lugar, el aminoácido se activa primero mediante la unión a una molécula de ARN de transferencia a través de un enlace éster. Este aminoacil-ARNt se produce en una reacción dependiente de ATP llevada a cabo por una aminoacil ARNt sintetasa . [120]Este aminoacil-ARNt es entonces un sustrato para el ribosoma , que cataliza el ataque del grupo amino de la cadena de proteína alargada en el enlace éster. [121] Como resultado de este mecanismo, todas las proteínas creadas por los ribosomas se sintetizan comenzando en su extremo N y avanzando hacia su extremo C.
Sin embargo, no todos los enlaces peptídicos se forman de esta manera. En algunos casos, los péptidos son sintetizados por enzimas específicas. Por ejemplo, el tripéptido glutatión es una parte esencial de las defensas de las células contra el estrés oxidativo. Este péptido se sintetiza en dos pasos a partir de aminoácidos libres. [122]En el primer paso, la gamma-glutamilcisteína sintetasa condensa la cisteína y el ácido glutámico a través de un enlace peptídico formado entre el carboxilo de la cadena lateral del glutamato (el carbono gamma de esta cadena lateral) y el grupo amino de la cisteína. Este dipéptido luego se condensa con glicina por la glutatión sintetasapara formar glutatión. [123]
En química, los péptidos se sintetizan por una variedad de reacciones. Uno de los más utilizados en la síntesis de péptidos en fase sólida utiliza los derivados de oxima aromáticos de aminoácidos como unidades activadas. Estos se agregan en secuencia a la cadena peptídica en crecimiento, que está unida a un soporte de resina sólida. [124] La capacidad de sintetizar fácilmente grandes cantidades de péptidos diferentes variando los tipos y el orden de los aminoácidos (utilizando química combinatoria ) ha hecho que la síntesis de péptidos sea particularmente importante en la creación de bibliotecas de péptidos para su uso en el descubrimiento de fármacos mediante la selección de alto rendimiento . [125]
Biosíntesis [ editar ]
En las plantas, el nitrógeno primero se asimila en compuestos orgánicos en forma de glutamato , formado a partir de alfa-cetoglutarato y amoníaco en la mitocondria. Para formar otros aminoácidos, la planta utiliza las transaminasas para mover el grupo amino a otro ácido alfa-ceto carboxílico. Por ejemplo, la aspartato aminotransferasa convierte glutamato y oxaloacetato en alfa-cetoglutarato y aspartato. [126] Otros organismos también usan transaminasas para la síntesis de aminoácidos.
Los aminoácidos no estándar generalmente se forman mediante modificaciones a los aminoácidos estándar. Por ejemplo, la homocisteína se forma a través de la vía de transulfuración o por la desmetilación de la metionina a través del metabolito intermedio S-adenosil metionina , [127] mientras que la hidroxiprolina se produce mediante una modificación postraduccional de la prolina . [128]
Los microorganismos y las plantas pueden sintetizar muchos aminoácidos poco comunes. Por ejemplo, algunos microbios producen ácido 2-aminoisobutírico y lantionina , que es un derivado de alanina con puentes de sulfuro. Ambos de estos aminoácidos se encuentran en lantibióticos peptídicos como la alameticina . [129] Sin embargo, en las plantas, el ácido 1-aminociclopropano-1-carboxílico es un pequeño aminoácido cíclico disustituido que es un intermedio clave en la producción de la hormona vegetal de etileno . [130]
Catabolismo [ editar ]
Los aminoácidos primero deben pasar de los orgánulos y las células a la circulación sanguínea mediante transportadores de aminoácidos , ya que los grupos amina y ácido carboxílico están típicamente ionizados. La degradación de un aminoácido, que ocurre en el hígado y los riñones, a menudo implica la desaminación al mover su grupo amino a alfa-cetoglutarato, formando glutamato . Este proceso involucra transaminasas, a menudo las mismas que las utilizadas en la aminación durante la síntesis. En muchos vertebrados, el grupo amino se elimina luego a través del ciclo de la urea y se excreta en forma de urea . Sin embargo, la degradación de los aminoácidos puede producir ácido úrico o amoníaco. Por ejemplo, la serina deshidratasa.convierte la serina en piruvato y amoniaco. [84]Después de la eliminación de uno o más grupos amino, el resto de la molécula a veces se puede usar para sintetizar nuevos aminoácidos, o se puede usar para obtener energía al ingresar a la glucólisis o al ciclo del ácido cítrico , como se detalla en la imagen de la derecha.
Propiedades fisicoquímicas de los aminoácidos [ editar ]
Los 20 aminoácidos codificados directamente por el código genético se pueden dividir en varios grupos según sus propiedades. Los factores importantes son la carga, la hidrofilicidad o la hidrofobia , el tamaño y los grupos funcionales. [38] Estas propiedades son importantes para la estructura de la proteína y proteína-proteína interacciones . Las proteínas solubles en agua tienden a tener sus residuos hidrófobos (Leu, Ile, Val, Phe y Trp) enterrados en el centro de la proteína, mientras que las cadenas laterales hidrófilas están expuestas al solvente acuoso. (Tenga en cuenta que en bioquímica , un residuo se refiere a un monómero específico dentro de la cadena polimérica de un polisacárido, proteína o ácido nucleico .) Las proteínas integrales de membrana tienden a tener anillos externos de aminoácidos hidrófobos expuestos que los anclan en la bicapa lipídica . En el caso parcial entre estos dos extremos, algunas proteínas de membrana periférica tienen un parche de aminoácidos hidrófobos en su superficie que se engancha en la membrana. De manera similar, las proteínas que tienen que unirse a moléculas cargadas positivamente tienen superficies ricas en aminoácidos cargados negativamente como el glutamato y el aspartato , mientras que las proteínas que se unen a moléculas cargadas negativamente tienen superficies ricas en cadenas cargadas positivamente como la lisinay arginina . Existen diferentes escalasde hidrofobicidad de los residuos de aminoácidos. [132]
Algunos aminoácidos tienen propiedades especiales, como la cisteína , que puede formar enlaces disulfurocovalentes a otros residuos de cisteína, la prolina que forma un ciclo al esqueleto del polipéptido y la glicina que es más flexible que otros aminoácidos.
Muchas proteínas experimentan un rango de modificaciones postraduccionales , cuando se unen grupos químicos adicionales a los aminoácidos en las proteínas. Algunas modificaciones pueden producir hidrófobos lipoproteínas , [133] o hidrófilos glicoproteínas . [134] Este tipo de modificación permite el direccionamiento reversible de una proteína a una membrana. Por ejemplo, la adición y eliminación del ácido palmítico ácido graso a los residuos de cisteína en algunas proteínas de señalización hace que las proteínas se adhieran y luego se desprendan de las membranas celulares. [135]
Tabla de abreviaturas y propiedades de aminoácidos estándar [ editar ]
| Aminoácidos | 3 letras[136] | 1 letra[136] | Cadena lateral
clase
| Cadena lateral
polaridad [136]
| Cadena lateral
carga (pH 7,4) [136]
| Índice de hidropatía [137] | Absorbencia | ε en | MW
(peso)
| Ocurrencia
en proteínas (%) [139]
| Codificación en el Código Genético Estándar (utilizando la notación IUPAC ) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Alanina | Ala | UNA | alifático | no polar | neutral | 1.8 | 89.094 | 8.76 | GCN | ||
| Arginina | Arg | R | BASIC | polar básico | positivo | −4.5 | 174.203 | 5.78 | MGN, CGY (los codones de codificación también pueden expresarse mediante: CGN, AGR) | ||
| Asparagina | Asn | norte | amida | polar | neutral | −3.5 | 132.119 | 3.93 | Aay | ||
| Ácido aspártico | Áspid | re | ácido | ácido polar | negativo | −3.5 | 133.104 | 5,49 | GAY | ||
| Cisteina | Cys | do | que contiene azufre | no polar | neutral | 2.5 | 250 | 0.3 | 121.154 | 1.38 | UGY |
| Ácido glutamico | Glu | mi | ácido | ácido polar | negativo | −3.5 | 147.131 | 6.32 | GAR | ||
| Glutamina | Gln | Q | amida | polar | neutral | −3.5 | 146.146 | 3.9 | COCHE | ||
| Glicina | Gly | sol | alifático | no polar | neutral | −0.4 | 75.067 | 7.03 | GGN | ||
| Histidina | Su | H | aromático básico | polar básico | positivo (10%) neutral (90%) | −3.2 | 211 | 5,9 | 155.156 | 2,26 | ISLA PEQUEÑA |
| Isoleucina | Ile | yo | alifático | no polar | neutral | 4.5 | 131.175 | 5,49 | AUH | ||
| Leucina | Leu | L | alifático | no polar | neutral | 3.8 | 131.175 | 9.68 | YUR, CUY (los codones de codificación también pueden expresarse mediante: CUN, UUR) | ||
| Lisina | Lys | K | BASIC | polar básico | positivo | −3.9 | 146.189 | 5.19 | AAR | ||
| Metionina | Reunió | METRO | que contiene azufre | no polar | neutral | 1.9 | 149.208 | 2,32 | AGO | ||
| Fenilalanina | Phe | F | aromático | no polar | neutral | 2.8 | 257, 206, 188 | 0.2, 9.3, 60.0 | 165.192 | 3.87 | UUY |
| Prolina | Pro | PAG | cíclico | no polar | neutral | −1.6 | 115.132 | 5.02 | CCN | ||
| Serina | Ser | S | que contiene hidroxilo | polar | neutral | −0.8 | 105.093 | 7.14 | UCN, AGY | ||
| Treonina | Thr | T | que contiene hidroxilo | polar | neutral | −0.7 | 119.119 | 5.53 | ACN | ||
| Triptófano | Trp | W | aromático | no polar | neutral | −0.9 | 280, 219 | 5.6, 47.0 | 204.228 | 1.25 | UGG |
| Tirosina | Tyr | Y | aromático | polar | neutral | −1.3 | 274, 222, 193 | 1.4, 8.0, 48.0 | 181.191 | 2.91 | UAY |
| Valina | Val | V | alifático | no polar | neutral | 4.2 | 117.148 | 6.73 | PISTOLA |
Dos aminoácidos adicionales están codificados en algunas especies por codones que generalmente se interpretan como codones de parada :
| 21 y 22 aminoácidos | 3 letras | 1 letra | MW (peso) |
|---|---|---|---|
| Selenocisteina | Segundo | U | 168.064 |
| Pirrolisina | Pyl | O | 255.313 |
Además de los códigos de aminoácidos específicos, los marcadores de posición se utilizan en los casos en que el análisis químico o cristalográfico de un péptido o proteína no puede determinar de manera concluyente la identidad de un residuo. También se utilizan para resumir motivos de secuencias de proteínas conservadas . El uso de letras individuales para indicar conjuntos de residuos similares es similar al uso de códigos de abreviatura para bases degeneradas . [140] [141]
| Aminoácidos ambiguos | 3 letras | 1 letra | Aminoácidos Incluidos | Codones incluidos |
|---|---|---|---|---|
| Cualquier / desconocido | Xaa | X | Todos | NNN |
| Asparagina o ácido aspártico | Asx | segundo | D, N | RAYO |
| Glutamina o ácido glutámico | Glx | Z | E, Q | SAR |
| Leucina o Isoleucina | Xle | J | ILLINOIS | YTR, ATH, CTY (los codones de codificación también se pueden expresar mediante: CTN, ATH, TTR; MTY, YTR, ATA; MTY, HTA, YTG) |
| Hidrofóbico | Φ | V, I, L, F, W, Y, M | NTN, TAY, TGG | |
| Aromático | Ω | F, W, Y, H | YWY, TTY, TGG (los codones de codificación también pueden expresarse mediante: TWY, CAY, TGG) | |
| Alifático (no aromático) | Ψ | V, I, L, M | VTN, TTR (los codones de codificación también pueden expresarse mediante: NTR, VTY) | |
| Pequeña | π | P, G, A, S | BCN, RGY, GGR | |
| Hidrofilico | ζ | S, T, H, N, Q, E, D, K, R | VAN, WCN, CGN, AGY (los codones de codificación también pueden expresarse mediante: VAN, WCN, MGY, CGP) | |
| Cargado positivamente | + | K, R, H | ARR, CRY, CGR | |
| Cargado negativamente | - | D, E | GAN |
Unk se usa a veces en lugar de Xaa , pero es menos estándar.








No hay comentarios:
Publicar un comentario