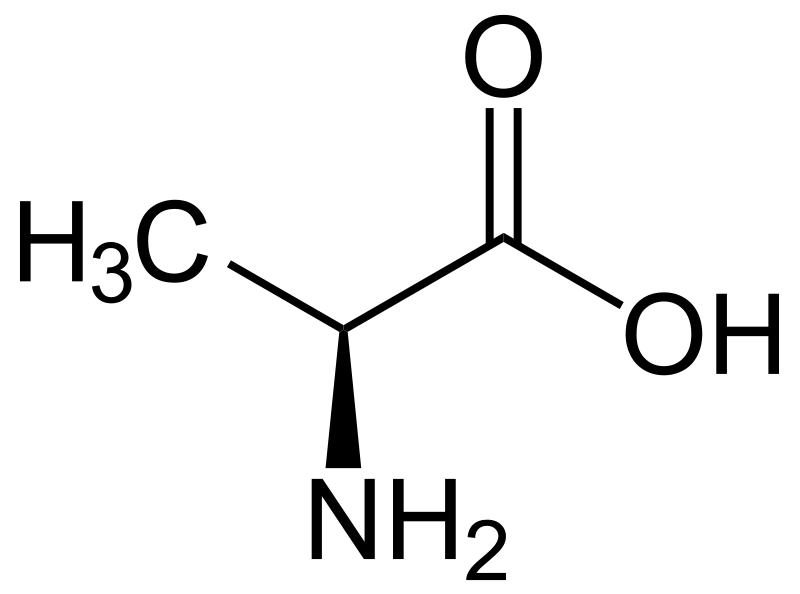
La alanina (símbolo Ala o A ) [3] es un α- aminoácido que se utiliza en la biosíntesis de proteínas . Contiene un grupo α-amino (que está en la forma protonada, −NH 3 + , en condiciones biológicas), un grupo ácido α-carboxílico (que está en la forma desprotonada, −COO - , en condiciones biológicas), y un la cadena lateral grupo metilo , lo que es un no polar , alifático aminoácido. No es esencial en los humanos: debido a que el cuerpo puede sintetizarlo, no necesita estar presente en la dieta. Está codificado por todos los codones. comenzando con GC (GCU, GCC, GCA, y GCG).
El isómero L - de alanina ( zurdo ) es el que se incorpora a las proteínas. La L- alanina ocupa el segundo lugar después de la leucina , ya que representa el 7.8% de la estructura primaria en una muestra de 1.150 proteínas . [4] La forma diestra, D- alanina aparece en polipéptidos en algunas paredes celulares bacterianas [5] p. 131 y en algunos antibióticos peptídicos , y se presenta en los tejidos de muchos crustáceos y moluscos como un osmolito .
Historia y etimología [ editar ]
La alanina fue sintetizada por primera vez en 1850 por Adolph Strecker . [7] [8] [9] El aminoácido se llamó alanina en alemán, en referencia al aldehído , con el infijo -an para facilitar la pronunciación, [10] la terminación alemana -in utilizada en compuestos químicos es análoga al inglés ine .
Estructura [ editar ]
La alanina es un alifático de aminoácidos, debido a que la cadena lateral conectado a la α-carbono átomo es un metilo grupo (-CH 3 ), lo que es el ácido α-amino simple a excepción de glicina . La cadena lateral de metilo de la alanina no es reactiva y, por lo tanto, casi nunca participa directamente en la función de la proteína. [11]
Debido a que la cadena lateral de alanina no puede ser fosforilada (solo se conocen compuestos como la 3-fosfino-L-alanina [12] y la 3-hidroxifosfinilalanina [13] ), es útil en experimentos de pérdida de función con respecto a la fosforilación . Algunas técnicas implican la creación de una biblioteca de genes, cada uno de los cuales tiene una mutación puntual en una posición diferente en el área de interés, a veces incluso cada posición en el gen completo: esto se denomina "mutagénesis de barrido". El método más simple, y el primero que se ha utilizado, es el llamado "escaneo de alanina", donde cada posición a su vez se muta a alanina. [14]
Fuentes [ editar ]
Las fuentes dietéticas [ editar ]
La alanina es un aminoácido no esencial , lo que significa que puede ser fabricado por el cuerpo humano y no necesita obtenerse a través de la dieta. La alanina se encuentra en una amplia variedad de alimentos, pero está particularmente concentrada en las carnes.
Biosíntesis [ editar ]
La alanina se puede sintetizar a partir de piruvato y aminoácidos de cadena ramificada como la valina , la leucinay la isoleucina .
La alanina es más comúnmente producida por la aminación reductiva de piruvato , un proceso de dos pasos. En el primer paso, el α-cetoglutarato , el amoníaco y el NADH se convierten por glutamato deshidrogenasa en glutamato , NAD + y agua. En la segunda etapa, el grupo amino del glutamato recién formado se transfiere a piruvato mediante una enzima aminotransferasa , regenerando el α-cetoglutarato y convirtiendo el piruvato en alanina. El resultado neto es que el piruvato y el amoníaco se convierten en alanina, consumiendo un equivalente reductor . [5] p. 721 porquelas reacciones de transaminación son fácilmente reversibles y el piruvato está presente en todas las células, la alanina se puede formar fácilmente y, por lo tanto, tiene vínculos estrechos con las vías metabólicas como la glucólisis , la gluconeogénesis y el ciclo del ácido cítrico .
Síntesis química [ editar ]
La alanina racémica se puede preparar mediante la condensación de acetaldehído con cloruro de amonio en presencia de cianuro de sodio mediante la reacción de Strecker o mediante la amonolisis del ácido 2-bromopropanoico : [15]
Degradación [ editar ]
La alanina se descompone por desaminación oxidativa , la reacción inversa de la reacción de aminación reductiva descrita anteriormente, catalizada por las mismas enzimas. La dirección del proceso está controlada en gran medida por la concentración relativa de los sustratos y los productos de las reacciones involucradas. [5] p.721
Función fisiológica [ editar ]
Ciclo de glucosa-alanina [ editar ]
En los mamíferos, la alanina desempeña un papel clave en el ciclo de glucosa-alanina entre los tejidos y el hígado. En los músculos y otros tejidos que degradan los aminoácidos del combustible, los grupos amino se recolectan en forma de glutamato mediante la transaminación . El glutamato puede transferir su grupo amino a piruvato , un producto de la glucólisis muscular , a través de la acción de la alanina aminotransferasa , formando alanina y α-cetoglutarato . La alanina entra en el torrente sanguíneo y se transporta al hígado. La reacción de alanina aminotransferasa tiene lugar en sentido inverso en el hígado, donde el piruvato regenerado se utiliza en la gluconeogénesis., formando glucosa que retorna a los músculos a través del sistema de circulación. El glutamato en el hígado entra en las mitocondrias y se descompone por la glutamato deshidrogenasa en α-cetoglutarato y amonio , que a su vez participa en el ciclo de la urea para formar la urea que se excreta a través de los riñones. [dieciséis]
El ciclo de glucosa-alanina permite eliminar el piruvato y el glutamato del músculo y transportarlos de manera segura al hígado. Una vez allí, el piruvato se usa para regenerar la glucosa, después de lo cual la glucosa regresa al músculo que se metaboliza para obtener energía: esto mueve la carga energética de la gluconeogénesis al hígado en lugar del músculo, y toda la ATP disponible en el músculo se puede dedicar al músculo contracción. [16] Es una vía catabólica y se basa en la descomposición de las proteínas en el tejido muscular. No está claro si y en qué medida se produce en los no mamíferos. [17] [18]
Enlace a la diabetes [ editar ]
Las alteraciones en el ciclo de la alanina que aumentan los niveles de alanina aminotransferasa (ALT) en suero están relacionadas con el desarrollo de la diabetes tipo II. [19]
Propiedades químicas [ editar ]
La estabilidad de los radicales libres [ editar ]
La desaminación de una molécula de alanina produce un radical libre de alquilo estable , CH 3 C • HCOO - . La desaminación se puede inducir en alanina sólida o acuosa por radiación. [20]
Esta propiedad de la alanina se utiliza en mediciones dosimétricasen radioterapia . Cuando se irradia la alanina normal, la radiación hace que ciertas moléculas de alanina se conviertan en radicales libres y, como estos radicales son estables, el contenido de radicales libres se puede medir más tarde mediante resonancia paramagnética electrónica para averiguar a qué radiación se expuso la alanina. . [21] Se considera que esta es una medida biológicamente relevante de la cantidad de daño por radiación que sufriría el tejido vivo bajo la misma exposición a la radiación. [21] Los planes de tratamiento con radioterapia se pueden administrar en modo de prueba a los gránulos de alanina, que luego se pueden medir para verificar que el sistema de tratamiento administra correctamente el patrón de dosis de radiación previsto.
Las albúminas ( / æ l b j ʊ m ɪ n / ; forman a partir de América : albumen [3] "(huevo) blanco; blanco de huevo seca") son una familiade proteínas globulares , la más común de las cuales son las albúminas de suero . Todas las proteínas de la familia de la albúmina son solubles en agua , moderadamente solubles en soluciones salinas concentradas y experimentan desnaturalización por calor . Las albúminas se encuentran comúnmente en el plasma sanguíneo y se diferencian de otras proteínas de la sangre en que no songlicosilado . Las sustancias que contienen albúminas, como la clara de huevo , se denominan albuminoides .
Un número de proteínas transportadoras de sangre están relacionadas evolutivamente, como la albúmina sérica, la alfa-fetoproteína , la proteína de unión a la vitamina D y la afamina . [4] [5] [6]

Función [ editar ]
La albúmina sérica es la principal proteína del plasma sanguíneo humano. [7] Se une al agua, a los cationes (como Ca 2+ , Na + y K + ), ácidos grasos , hormonas, bilirrubina , tiroxina (T4) y productos farmacéuticos (incluidos los barbitúricos): su función principal es regular la presión oncótica de sangre. La alfa-fetoproteína(alfa-fetoglobulina) es una proteína plasmática fetal que se une a varios cationes, ácidos grasos y bilirrubina. La proteína de unión a la vitamina D se une a la vitamina D y sus metabolitos, así como a los ácidos grasos. El punto isoeléctrico de albúmina es 4.9.
Estructura [ editar ]
La estructura 3D de la albúmina sérica humana se ha determinado mediante cristalografía de rayos X a una resolución de 2.5 ångströms (250 pm). [8] La albúmina es una proteína de 65–70 kDa .
La albúmina comprende tres dominios homólogos que se ensamblan para formar una proteína en forma de corazón. [2] Cada dominio es un producto de dos subdominios que poseen motivos estructurales comunes. [2] Las regiones principales de la unión del ligando a la albúmina sérica humana están ubicadas en cavidades hidrófobas en los subdominios IIA y IIIA, que muestran una química similar. Estructuralmente, las albúminas de suero son similares, cada dominio contiene cinco o seis enlaces disulfuro internos, como se muestra esquemáticamente a continuación:
┌───┐ ┌────┐ ┌─────┐
│ │ │ │ │
○○ C ○○○○○○○○○○○○○○○○ CC ○○ C ○○○○ C ○○○○○ CC ○○○ C ○○○○○○○○○ C ○○ ○○○○○○○○○○○○ CC ○○○○ C ○○
│ │ │ │ │
└─────────────────┘ └──────┘ └───────────────┘
C: cisteína, ○: cualquier aminoácido
La albúmina sérica [ editar ]
La albúmina sérica es la proteína de plasma sanguíneo más abundante y se produce en el hígado y forma una gran proporción de todas las proteínas plasmáticas. La versión humana es albúmina de suero humano , y normalmente constituye alrededor del 50% de la proteína plasmática humana. [7]
Las albúminas de suero son importantes para regular el volumen de sangre al mantener la presión oncótica(también conocida como presión osmótica coloide ) del compartimiento de la sangre. [7] También sirven como portadores de moléculas de baja solubilidad en agua, aislando así su naturaleza hidrófoba, incluidas las hormonas liposolubles, sales biliares , bilirrubina no conjugada , ácidos grasos libres ( apoproteína ), calcio , iones ( transferrina).), y algunos medicamentos como la warfarina, fenobutazona, clofibrato y fenitoína. Por esta razón, a veces se lo denomina "taxi" molecular. La competencia entre los fármacos para los sitios de unión a la albúmina puede causar la interacción del fármaco al aumentar la fracción libre de uno de los fármacos, lo que afecta la potencia.
Los tipos específicos incluyen:
- albúmina de suero humano
- albúmina sérica bovina ( albúmina sérica bovina ) o BSA, a menudo utilizada en laboratorios de biología molecular y médica.
Niveles de albúmina sérica [ editar ]
El rango normal de albúmina sérica humana en adultos (> 3 años) es de 3.5 a 5 g / dL. Para los niños menores de tres años, el rango normal es más amplio, 2.9–5.5 g / dL. [9]
La albúmina baja ( hipoalbuminemia ) puede ser causada por enfermedad hepática , síndrome nefrótico , quemaduras, enteropatía por pérdida de proteínas , malabsorción , desnutrición , embarazo tardío, artefactos, variaciones genéticas y malignidad.
La albúmina alta ( hiperalbuminemia ) casi siempre es causada por la deshidratación. En algunos casos de deficiencia de retinol ( vitamina A ), el nivel de albúmina puede elevarse a valores altos normales (por ejemplo, 4.9 g / dL). Esto se debe a que el retinol hace que las células se hinchen con agua (esta es también la razón por la que la vitamina A es tóxica). [10] Esta hinchazón también es probable que ocurra durante el tratamiento con ácido retinoico 13-cis ( isotretnoína ), un medicamento para el tratamiento del acné grave, entre otras afecciones. En experimentos de laboratorio, se ha demostrado que el ácido retinoico todo trans regula a la baja la producción de albúmina humana. [11]
Otros tipos de albúmina [ editar ]
Otros tipos de albúmina incluyen la proteína de almacenamiento ovoalbúmina en clara de huevo y diferentes albúminas de almacenamiento en las semillas de algunas plantas , incluido el cáñamo . [12]
- Tenga en cuenta que la proteína "albúmina" se deletrea con una "i", mientras que "albúmina" con una "e" es la clara de un huevo, que contiene (entre otras cosas) varias docenas de tipos de albúmina (con una "i" ), en su mayoría ovoalbúmina .
Usos médicos [ editar ]
Para los pacientes con bajo volumen sanguíneo, no hay evidencia de que la albúmina reduzca la mortalidad en comparación con alternativas más baratas como la solución salina normal , o que la albúmina reduzca la mortalidad en pacientes con quemaduras y niveles bajos de albúmina. Por lo tanto, la Colaboración Cochranerecomienda que no se use, excepto en ensayos clínicos . [13] [ necesita actualización ]
En la vaporización acústica de gotitas (ADV), la albúmina se usa a veces como surfactante . El ADV se ha propuesto como un tratamiento contra el cáncer mediante la terapia de oclusión . [14]
La albúmina sérica humana se puede usar para revertir potencialmente la toxicidad de los medicamentos / químicos mediante la unión al agente / fármaco libre. [15]
Usos forenses [ editar ]
En todo el mundo, ciertas medicinas tradicionales chinas contienen bilis de oso salvaje, prohibida por la legislación CITES . Palitos de inmersión, similares a las pruebas de embarazo comunes, se han desarrollado para detectar la presencia de albúmina de oso en productos de medicina tradicional, lo que indica que la bilis de oso se había utilizado en su creación.



No hay comentarios:
Publicar un comentario