Isótopos ambientales
carbono-12 es el más abundante de los dos isótopos estables del elemento carbono, representando el 98,89% de todo el carbono terrestre. Está conformado por 6 protones, 6 neutrones y 6 electrones.
Adquiere particular importancia al usarse como patrón para el cálculo de la masa atómica de los distintosnucleidos existentes en la naturaleza; dado que la masa atómica del 12C es, por definición, 12 umas.
Historia
Antes de 1959, tanto la IUPAP como la IUPAC tendían a utilizar el oxígeno para definir el mol. La comunidad química definía al mol como el número de átomos de oxígeno que tenían una masa de 16 g, mientras que la física usaba una definición similar pero sólo con el isótopo oxígeno-16. Las dos organizaciones acordaron entre 1959 y1960 definir al mol como:
- El mol es la cantidad de sustancia de un sistema que contiene tantas unidades elementales como hay en 12 gramos de carbono-12; su símbolo es el "mol".
Esta definición fue adoptada por el Comité Internacional de Pesos y Medidas (CPIM), en 1967, y en 1971 fue adoptada por la 14ª Conferencia General de Pesos y Medidas.
El estado de Hoyle
En los años 50 el matemático y astrofísico Fred Hoyle predijo la existencia de un estado resonante del carbono-12 a la energía de 7.65 MeV cuya presencia era necesaria para explicar las abudancias de elementos más pesados en el universo. La existencia de este estado ha sido confirmada experimentalmente, aunque algunas de sus propiedades están aún bajo estudio.
El carbono-13 (13C) es un isótopo estable natural del carbono y uno de los isótopos ambientales, ya que forma parte en una proporción del 1,1 % de todo el carbono natural de la Tierra.
Detección por espectroscopia NMR
Debido a sus propiedades de los spines nucleares, con un spin de +1/2, justo como el átomo de hidrógeno, este isótopo responde a una señal resonante de radiofrecuencia (RF). La absorción y emisión de la señal RF por losnúcleos atómicos puede monitorearse y detectarse usando espectroscopia de resonancia magnética nuclear, más conocida como espectroscopia NMR. Esta es una técnica que sirve para dar información de la identidad y número de átomos adyacentes a otros átomos en dicha molécula, dando la agrupación de la estructura de una molécula orgánica. Desde que 12C tiene "spin cero", no da una señal NMR, y solo el 1% de los átomos en una molécula son13C, no es querido que el acoplamiento carbono-carbono se vea. Para la adquisición del espectro NMR 13C puede tardar de unos minutos a horas debido a muchos escanes para lograr resultados distinguibles del ruido nuclear de fondo por causas nobles.
En las proteínas NMR biológica se puede deliberadamente marcar con 13C (y usualmente nitrógeno-15) para facilitar la determinación de la estructura de las proteínas.
Esto es activado por crecimiento de microorganismos genéticamente modificados para expresar la proteína en un medio de crecimiento con glucosa marcada con 13C como única fuente de carbono. En esta vía, las proteínas con un contenido de 13C del 100% pueden producirse.
Detección por espectrometría de masas
Un espectograma de masa de un compuesto orgánico usualmente contendrá un pequeño pico de una unidad de masa más grande que el aparente pico molecular del ion (M). Esto se conoce como el pico M+1 y se origina debido a la presencia de átomos 13C. Una molécula conteniendo un átomo de carbono se esperará que tenga un pico M+1 de approximadamente 1,1% del tamaño del pico M como ese 1,1% de átomos de carbono serán 13C más que 12C. Similarmente una molécula con dos átomos de carbono tendrá un pico M+1 de aproximadamente 2,2% del tamaño del pico M, siendo doble por la completa probabilidad que la molécula contenga un átomo 13C.
En lo de arriba se han simplificado la matemática y la química, sin embargo puede usarse efectivamente para dar el número de átomos de carbono de moléculas de tamaño pequeño a mediano. En la siguiente fórmula, el resultado debería redondearse al entero más cercano:
donde C es el número de átomos de C, X es la amplitud del pico del ion M e Y es la amplitud del pico de ion M+1
Los compuestos enriquecidos de 13C se usan en estudios de procesos metabólicos por medio de la espectrometría de masas. Tales compuestos son seguros debido a que no son radioactivos. Además, el 13C se usa para cuantificar proteínas (proteómica cuantitativa). Otra importante aplicación es marcar isótopos estables con aminoácidos en cultivo de células (acrónimo en inglés:SILAC).
El núcleo 13C también muestra resonancia magnética nuclear ya que, al igual que los protones, tiene espín ½. Su abundancia es de sólo el 1,1 % y por ello no es normal ver el acoplamiento entre núcleos de carbono. El núcleo de 13C es unas 400 veces menos sensible que los protones en la RMN. Los desplazamientos químicos, también medidos con respecto al tetrametilsilano (TMS), se encuentran en el rango de 0-220 ppm y son afectados por los mismos factores que en el caso de los protones.
El número de picos en el espectro indica el número de tipos de carbono presentes en la sustancia analizada. Por ejemplo, en el espectro del pentano aparecen tres señales.
Este espectro tan sencillo se obtiene suprimiendo los acoplamientos que se producen entre los átomos de carbono y los de hidrógeno, en caso contrario el espectro obtenido puede ser muy complejo. Sin embargo, a veces interesa obtener el espectro off-resonance. En él los picos del carbono aparecen como señales múltiples según el número de átomos de hidrógeno unidos al carbono: si hay dos da lugar a un triplete, si hay tres a un cuartete (regla de n+1).
Los factores que influyen en el desplazamiento químico del las señales en el RMN 13C son:
- electronegatividad de los grupos unidos al carbono
- hibridación del carbonoINTERPRETACIÓN DE ESPECTROS RMN 13C
etanol CH3CH2OH en CDCl3
| etanol CH3CH2OH en D2O |
1-propanol CH3CH2CH2OH en CDCl3
|
|---|---|---|
2-propanol (CH3)2CHOH en CDCl3
|
tbutanol (CH3)3COH en CDCl3
|
2-butanol CH3CH2CH(OH)CH3 en CDCl3
|
toluene C6H5CH3 en CDCl3
|
etil benceno C6H5CH2CH3 en CDCl3
|
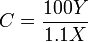
No hay comentarios:
Publicar un comentario