Las células de los glúteos son células con apariencia de muesca que se encuentran en ciertos tumores malignos, [1] como el linfoma no Hodgkin (incluido el linfoma folicular ), [2] [3] micosis fungoide , [4] y el síndrome de Sézary .
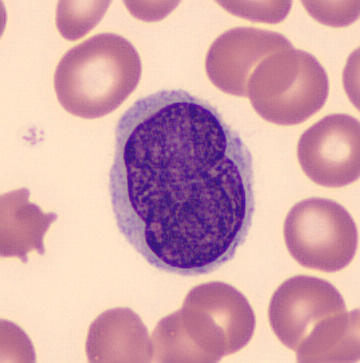
Células de glúteos observadas en el síndrome de Sézary
Célula progenitora endotelial (o EPC, por sus siglas en inglés) es un término que se ha aplicado a múltiples tipos de células diferentes que desempeñan un papel en la regeneración del revestimiento endotelial de los vasos sanguíneos . Las células endoteliales de crecimiento son un subtipo de EPC comprometido con la formación de células endoteliales. [1] A pesar de la historia y la controversia, el EPC en todas sus formas sigue siendo un objetivo prometedor de la investigación en medicina regenerativa .
Historia y controversia [ editar ]
En el desarrollo, el endotelio surge en contacto cercano con el sistema hematopoyético . Esto, y la existencia de endotelio hemogénico , llevaron a la creencia y la búsqueda de células similares a hemangioblastos o angioblastos adultos ; Células que podrían dar lugar a la vasculatura funcional en adultos. [2] La existencia de células progenitoras endoteliales se ha postulado desde mediados del siglo XX, sin embargo, su existencia no se confirmó hasta la década de 1990, cuando Asahara et al. Publicó el descubrimiento del primer EPC putativo. [3]
Recientemente, se ha desarrollado una controversia sobre la definición de progenitores endoteliales verdaderos. [4] Aunque parece que las células derivadas de la médula ósea se localizan en los vasos lesionados y promueven un cambio angiogénico, otros estudios han sugerido que estas células no contribuyen directamente al endotelio funcional, sino que actúan a través de métodos paracrinos para brindar apoyo a las células endoteliales residentes . [5] [6] Si bien otros autores han cuestionado estos, y sostienen que son verdaderos EPC, [7] muchos investigadores han comenzado a denominar a estas células colonia formadoras de colonias (CFU-Hill) o células angiogénicas circulantes (CAC). ) en cambio (dependiendo del método de aislamiento), destacando su papel como mieloide hematopoyéticoCélulas involucradas en promover el crecimiento de nuevos vasos. [8] [9]
El análisis genético molecular de las poblaciones de EPC putativas de crecimiento temprano sugiere que sí tienen patrones de expresión similares a los de los monocitos , y respaldan la existencia de una población separada de progenitores, el crecimiento tardío o la célula formadora de colonias endoteliales (ECFC). [10]Además, las células de crecimiento temprano mantienen otras funciones de monocitos, como la alta captación de tinta Dil-Ac-LDL e India y la baja expresión de eNOS . También se muestra que estos brotes iniciales, CFU-Hill o CAC originales expresan CD14 , un receptor de lipopolisacáridos expresado por monocitos pero no por células endoteliales. [11]
Las células formadoras de colonias endoteliales representan una población distinta que se ha encontrado que tiene el potencial de diferenciar y promover la reparación de vasos. Se sabe que las ECFC son células progenitoras residentes en el tejido en adultos que mantienen cierta capacidad vasculogénica. [12]
Clasificaciones [ editar ]
Por el método de aislamiento y la función celular, se han descrito tres poblaciones principales de supuestas EPC de adultos. El comportamiento de las celdas se puede encontrar en la siguiente tabla. [9] [13]
| Unidad formadora de colonia - Colina | Célula angiogénica circulante | Columna endotelial formadora de células | |
|---|---|---|---|
| Estado proliferativo clonal | - | - | + |
| Capacidad de replanteo | - | - | + |
| Formación de tubos in vitro. | +/- | +/- | + |
| In vivo de la formación de vasos novo. | - | - | + |
| Homing a sitios isquémicos en vivo | + | + | + |
| Soporte paracrino de la angiogénesis. | + | + | + |
Las EPC también tienen marcadores fenotípicos variables utilizados para la identificación. Desafortunadamente, no hay marcadores únicos para los progenitores endoteliales que no se compartan con otras células endoteliales o hematopoyéticas, lo que ha contribuido a la controversia histórica que rodea el campo. Puede encontrar una descripción detallada de los marcadores actuales en la siguiente tabla. [2] [13]
| Unidad formadora de colonia - Colina | Célula angiogénica circulante | Columna endotelial formadora de células | |
|---|---|---|---|
| Expresión de CD34 | +/- | +/- | +/- |
| Expresión de CD133 | + | + | - |
| Expresión de CD45 | +/- | +/- | - |
| Expresión de CD146 | +/- | +/- | + |
| Expresión de cadherina VE | +/- | +/- | ++ |
| Expresión de CD115 | + | + | - |
| Expresión de CD31(PECAM) | + | + | + |
| Expresión de CD14 | + | + | - |
| Expresión de CD105 | + | + | + |
| CD117 (ckit) expresión | + | + | +/- |
| Expresión VEGFR1 | + | + | + |
| Expresión VEGFR2 (KDR / Flk1) | + | + | ++ |
| Expresión TIE-2 | + | + | + |
| Expresión CXCR4 | + | + | +/- |
| Expresión del factor de von Willebrand | +/- | +/- | + |
| ALDH | Brillante | Brillante | Brillante |
| consumo de LDL ac | + | + | + |
Unidad de formación de colonia - colina [ editar ]
Como se aisló originalmente por Asahara et al., La población de CFU-Hill es un brote temprano, formado por placas de células mononucleares de sangre periférica en placas recubiertas con fibronectina, permitiendo la adhesión y el agotamiento de las células no adherentes, y aislando colonias discretas. [8] [9]
Circulantes célula angiogénica [ editar ]
Un método similar es cultivar la fracción mononuclear de sangre periférica en medio de crecimiento endotelial suplementado, eliminando las células no adherentes y aislando el resto. Si bien estas células muestran algunas características endoteliales, no forman colonias. [8] [9]
Célula formadora de colonia endotelial [ editar ]
Las células formadoras de colonias endoteliales son un tipo de células de crecimiento tardío; es decir, solo se aíslan después de un cultivo significativamente más largo que las células CFU-Hill. Los ECFC se aíslan colocando placas de la fracción mononuclear de sangre periférica en placas recubiertas con colágeno, eliminando las células no adherentes y cultivando durante semanas hasta la aparición de colonias con una morfología distintiva de adoquines. Estas células son fenotípicamente similares a las células endoteliales y se ha demostrado que crean estructuras similares a vasos in vitro e in vivo. [8] [9]
Desarrollo [ editar ]
Ciertas células del desarrollo pueden ser similares o similares a otros progenitores endoteliales, aunque no suelen denominarse EPC. Los hemangioblastos (o su contraparte in vitro, células formadoras de colonias de blastos) son células que se cree que dan lugar a los sistemas endotelial y hematopoyético durante el desarrollo temprano. Se cree que los angioblastos son una forma de células progenitoras o progenitoras tempranas que dan origen al endotelio solo. Más recientemente, los mesoangioblastos se han teorizado como una célula que da lugar a múltiples tejidos mesodérmicos . [14] [15] [16]
Función [ editar ]
Papel en el crecimiento del tumor [ editar ]
Las células progenitoras endoteliales son probablemente importantes en el crecimiento del tumor y se cree que son críticas para la metástasis y la angiogénesis. [17] [18] Se ha realizado una gran cantidad de investigaciones sobre los EPC putativos derivados de la médula ósea de CFU-Hill. La ablación de las células progenitoras endoteliales en la médula ósea conduce a una disminución significativa en el crecimiento del tumor y el desarrollo de la vasculatura. Esto indica que las células progenitoras endoteliales presentan nuevas dianas terapéuticas. [19] El inhibidor de la unión de ADN 1 ( ID1 ) se ha utilizado como marcador para estas células; [20] esto permite rastrear las EPC desde la médula ósea hasta la sangre hasta el estroma tumoral e incluso incorporadas en la vasculatura tumoral.
Recientemente se ha encontrado que los miRNAs regulan la biología de EPC y la angiogénesis tumoral. Este trabajo de Plummer et al. encontraron que, en particular, la orientación de los miRNAs miR-10b y miR-196b condujo a defectos significativos en el crecimiento del tumor mediado por la angiogénesis al disminuir la movilización de las EPC proangiogénicas hacia el tumor. Estos hallazgos indican que el direccionamiento dirigido a estos miRNAs en las EPC puede resultar en una estrategia novedosa para inhibir la angiogénesis tumoral. [21]
Los estudios han demostrado que las ECFC y las células endoteliales de la vena umbilical humana (HUVEC, por sus siglas en inglés) tienen una capacidad para la migración tumoral y la neoangiogénesis incluso mayor que la de otras células hematopoyéticas CD34 + cuando se implantan en ratones inmunodeficientes, lo que sugiere que los progenitores endoteliales desempeñan un papel clave, pero respaldan aún más la Importancia de ambos tipos de células como dianas para la terapia farmacológica. [22]
Papel en las enfermedades cardiovasculares [ editar ]
Se detectaron niveles más altos de "células progenitoras endoteliales" circulantes en el torrente sanguíneo de los pacientes, se pronosticaron mejores resultados y los pacientes experimentaron menos ataques cardíacos repetidos, [23] aunque las correlaciones estadísticas entre estos resultados y el número de células progenitoras endoteliales circulantes fueron escasas en la investigación original . Las células progenitoras endoteliales se movilizan después de un infarto de miocardio y funcionan para restablecer el revestimiento de los vasos sanguíneos dañados durante el ataque cardíaco.
Una serie de ensayos clínicos de fase pequeña han comenzado a señalar a las EPC como un tratamiento potencial para varias enfermedades cardiovasculares (ECV). Por ejemplo, el "Transplante de Células Progenitoras y la Mejora de la Regeneración en el Infarto Agudo de Miocardio" (TOPCARE-AMI), de un año de duración, estudió el efecto terapéutico de la infusión de EPC de médula ósea expandida ex vivo y las EPC enriquecidas en cultivo derivadas de sangre periférica en 20 pacientes que padecen Infarto agudo de miocardio (IM). Después de cuatro meses, se encontraron mejoras significativas en la fracción de eyección ventricular, la geometría cardíaca, la reserva de flujo sanguíneo coronario y la viabilidad miocárdica (Shantsila, Watson y Lip). Un estudio similar examinó los efectos terapéuticos de las EPC en la isquemia de la pierna causada por una enfermedad arterial periférica grave. El estudio inyectó una muestra de sangre rica en EPC en los músculos gastrocnemios de 25 pacientes. Después de 24 semanas, se observó un aumento en el número de vasos colaterales y una mejor recuperación en la perfusión sanguínea. También se observó que el dolor en reposo y la marcha sin dolor mejoraron[24]
Papel en la cicatrización de heridas [ editar ]
El papel de las células progenitoras endoteliales en la cicatrización de heridas sigue sin estar claro. Se ha visto que los vasos sanguíneos ingresan en el tejido isquémico en un proceso impulsado por el ingreso forzado mecánicamente de los capilares existentes en la región avascular y, lo que es más importante, en lugar de brotar a través de la angiogénesis. Estas observaciones contradicen la brotación de la angiogénesis impulsada por las EPC. Tomado junto con la incapacidad de encontrar endotelio derivado de la médula ósea en la nueva vasculatura, ahora hay poco apoyo material para la vasculogénesis posnatal. En cambio, la angiogénesis es probablemente impulsada por un proceso de fuerza física. [25]
Papel en la endometriosis [ editar ]
En la endometriosis , parece que hasta el 37% del endotelio microvascular del tejido endometrial ectópico se origina a partir de células progenitoras endoteliales.
No hay comentarios:
Publicar un comentario