Las células madre hematopoyéticas ( HSCs ) son las células madre que dan lugar a otras células sanguíneas . Este proceso se llama hematopoyesis . [1] Este proceso ocurre en la médula ósea roja , en el núcleo de la mayoría de los huesos. En el desarrollo embrionario, la médula ósea roja se deriva de la capa del embriónllamada mesodermo .
La hematopoyesis es el proceso por el cual se producen todas las células sanguíneas maduras. Debe equilibrar las enormes necesidades de producción (la persona promedio produce más de 500 mil millones de células sanguíneas cada día) con la necesidad de regular con precisión el número de cada tipo de célula sanguínea en la circulación. En los vertebrados, la gran mayoría de la hematopoyesis ocurre en la médula ósea y se deriva de un número limitado de células madre hematopoyéticas (HSCs) que son multipotentes y capaces de una amplia renovación.
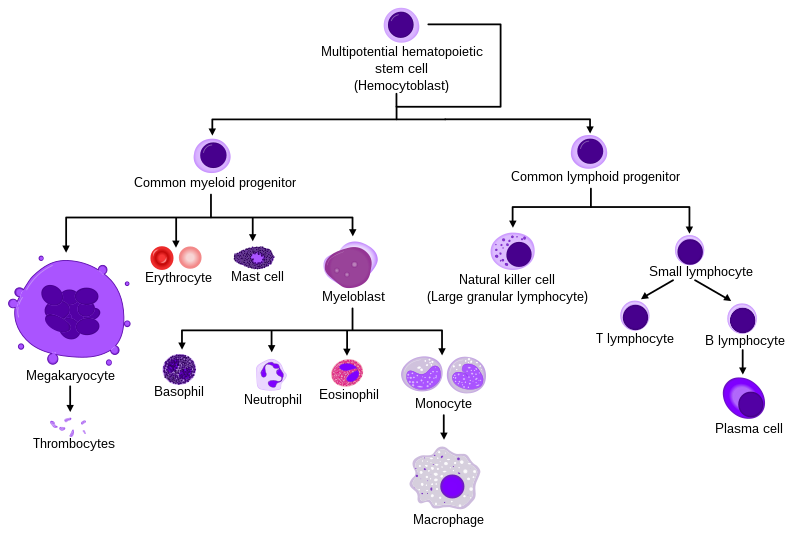
Las HSC dan lugar a los linajes mieloide y linfoide de las células sanguíneas. Los linajes mieloide y linfoide están involucrados en la formación de células dendríticas. Las células mieloides incluyen monocitos , macrófagos , neutrófilos , basófilos , eosinófilos , eritrocitos y megacariocitos en las plaquetas . Las células linfoides incluyen células T , células B y células asesinas naturales . La definición de células madre hematopoyéticas ha evolucionado desde que las HSC se descubrieron por primera vez en 1961. [2]El tejido hematopoyético contiene células con capacidades de regeneración a largo y corto plazo y progenitores multipotentes , oligopotentes y unipotentes comprometidos . Las HSC constituyen 1: 10.000 de células en tejido mieloide .
Los trasplantes de HSC se utilizan en el tratamiento de cánceres y otros trastornos del sistema inmunológico.
Estructura [ editar ]
Con respecto a la morfología, las células madre hematopoyéticas se parecen a los linfocitos . Son no adherentes y redondeados, con un núcleo redondeado y una baja relación citoplasma a núcleo. Como las HSC no se pueden aislar como una población pura, no es posible identificarlas en un microscopio.
Ubicación [ editar ]
Las HSC se encuentran en la médula ósea de los adultos, especialmente en la pelvis , el fémur y el esternón . También se encuentran en la sangre del cordón umbilical y, en pequeñas cantidades, en la sangre periférica . [4]
Se pueden extraer células madre y progenitoras de la pelvis, en la cresta ilíaca, con una aguja y una jeringa. [5] Las células se pueden extraer como líquido (para realizar un frotis para observar la morfología celular) o se pueden extraer mediante una biopsia central (para mantener la arquitectura o la relación de las células entre sí y con el hueso). [ cita requerida ]
Para extraer células madre de la sangre periférica circulante, a los donantes de sangre se les inyecta una citoquina , como el factor estimulante de colonias de granulocitos (G-CSF), que induce a las células a abandonar la médula ósea y circular en los vasos sanguíneos. [6] En la embriología de los mamíferos, las primeras HSC definitivas se detectan en la AGM ( aorta-gonad-mesonefros ) y luego se expanden masivamente en el hígado fetal antes de colonizar la médula ósea antes del nacimiento. [7]
Variación [ editar ]
Originalmente se creía que todas las HSC eran iguales en sus capacidades de auto-renovación y diferenciación. Esta visión fue cuestionada por primera vez por el descubrimiento de 2002 por el grupo Muller-Sieburg en San Diego, quien ilustró que diferentes células madre pueden mostrar patrones de repoblación distintos que son propiedades intrínsecas epigenéticamente predeterminadas del clonal Thy-1 lo Sca-1 + lin - c- kit + HSC. [8] [9] [10]Los resultados de estos estudios clonales condujeron a la noción de sesgo de linaje . Usando la relaciónde células linfoides (L) a mieloides (M) en la sangre como marcador cuantitativo, el compartimiento de células madre se puede dividir en tres categorías de HSC. Las HSC balanceadas (Bala) repoblan los glóbulos blancos periféricos en la misma proporción de células mieloides a células linfoides como se observa en ratones no manipulados (en promedio, aproximadamente un 15% de células mieloides y un 85% de células linfoides, o 3 ≤ ρ ≤ 10). Las HSC con sesgo mieloide (My-bi) dan lugar a muy pocos linfocitos que dan como resultado relaciones 0 <ρ <3 font="" mientras="" nbsp="" que="">las HSC con sesgo linfoide (Ly-bi)generan muy pocas células mieloides, lo que da como resultado relaciones linfoides a mieloides de ρ> 10. Los tres tipos son tipos normales de HSC y no representan etapas de diferenciación. Más bien, estas son tres clases de HSC, cada una con un programa de diferenciación fijo epigenéticamente. Estos estudios también mostraron que el sesgo de linaje no está regulado estocásticamente o depende de las diferencias en la influencia ambiental. My-bi HSC se renueva por sí mismo por más tiempo que el HSC Ly-bi balanceado. El sesgo mieloide es el resultado de una respuesta reducida a la linopoyetina interleucina 7 (IL-7). [9]
Posteriormente, otros grupos confirmaron y destacaron los hallazgos originales. [11] Por ejemplo, el grupo Eaves confirmó en 2007 que las cinéticas de repoblación, la capacidad de renovación automática a largo plazo y My-bi y Ly-bi son propiedades de HSC intrínsecas heredadas de forma estable. [12] En 2010, el grupo Goodell proporcionó información adicional sobre las bases moleculares del sesgo de linaje en la población lateral (SP) SCA-1 + lin - c-kit + HSC. [13] Como se mostró anteriormente para la señalización de IL-7, se encontró que un miembro de la familia del factor de crecimiento transformante (TGF-beta) induce e inhibe la proliferación de My-bi y Ly-bi HSC, respectivamente.
Marcadores [ editar ]
Este artículo puede contener una cantidad excesiva de detalles complejos que pueden interesar solo a una audiencia en particular . ( Agosto de 2015 ) ( Aprenda cómo y cuándo eliminar este mensaje de plantilla )
|
Las HSC pueden identificarse o aislarse mediante el uso de citometría de flujo, donde se utiliza la combinación de varios marcadores de superficie celular diferentes para separar las HSC raras de las células sanguíneas circundantes. Las HSC carecen de expresión de marcadores de células sanguíneas maduras y, por lo tanto, se llaman Lin-. La falta de expresión de los marcadores de linaje se usa en combinación con la detección de varios marcadores positivos de la superficie celular para aislar HSC. Además, las HSC se caracterizan por su pequeño tamaño y bajo la tinción con colorantes vitales, tales como rodamina 123 (rodamina Mín ) o Hoechst 33342 (población lateral).
Cluster de diferenciación y otros marcadores [ editar ]
El marcador clásico de HSC humana es CD34 descrito por primera vez de forma independiente por Civin et al. y Tindle et al. [14] [15] [16] [17] Se utiliza para aislar HSC para la reconstitución de pacientes que son hematológicamente incompetentes como resultado de la quimioterapia o la enfermedad.
Muchos marcadores pertenecen al grupo de series de diferenciación , como: CD34 , CD38 , CD90 , CD133 , CD105 , CD45 y también c-kit , el receptor del factor de células madre .
Hay muchas diferencias entre los marcadores de células hematopoyéticas humanas y murinas para el tipo comúnmente aceptado de células madre hematopoyéticas. [18]
- HSC del ratón : EMCN + , CD34 lo / - , SCA-1 + , Thy1.1 + / lo , CD38 + , C-kit + , lin -
- HSC humano : EMCN + , CD34 + , CD59 + , Thy1 / CD90 + , CD38 lo / - , C-kit / CD117 + , lin -
Sin embargo, no todas las células madre están cubiertas por estas combinaciones que, sin embargo, se han vuelto populares. De hecho, incluso en humanos, hay células madre hematopoyéticas que son CD34 - / CD38 - . [19] [20] También algunos estudios posteriores sugirieron que las primeras células madre pueden carecer de c-kit en la superficie celular. [21] Para las HSC humanas, el uso de CD133 fue un paso adelante ya que tanto CD34 +como CD34 - HSC fueron CD133 + .
El método de purificación tradicional utilizado para obtener un nivel de pureza razonable de células madre hematopoyéticas de ratón, en general, requiere una gran cantidad de marcadores (~ 10–12), la mayoría de los cuales eran marcadores sustitutos con poca importancia funcional, y por lo tanto se superponen parcialmente con el tallo poblaciones de células y, a veces, otras células estrechamente relacionadas que no son células madre. Además, algunos de estos marcadores (por ejemplo, Thy1 ) no están conservados en todas las especies de ratón, y el uso de marcadores como CD34 - para la purificación HSC requiere ratones para tener al menos 8 semanas de edad.
Código SLAM [ editar ]
Los métodos alternativos que podrían dar lugar a una cosecha similar o mejor de células madre es un área activa de investigación, y son actualmente [ ¿cuándo? ] Emergentes. Uno de estos métodos utiliza una firma de moléculas de superficie celular de la familia SLAM . La familia SLAM ( molécula de activación de linfocitos de señalización ) es un grupo de más de 10 moléculas cuyos genes se encuentran en su mayoría en tándem en un solo locus en el cromosoma 1 (ratón), todos pertenecientes a un subconjunto de la superfamilia de genes de inmunoglobulina, y originalmente se pensaba que eran Participa en la estimulación de células T. Esta familia incluye CD48 , CD150, CD244, etc., siendo CD150 el miembro fundador y, por lo tanto, también conocido como slamF1, es decir, miembro 1 de la familia SLAM.
Los códigos de la firma SLAM para la jerarquía hemopoyética son:
- Células madre hematopoyéticas (HSC) : CD150 + CD48 - CD244 -
- Células progenitoras multipotentes (MPP) : CD150 - CD48 - CD244 +
- Células progenitoras con restricción de linaje (LRP) : CD150 - CD48 + CD244 +
- Progenitor mieloide común (CMP) : lin - SCA-1 - c-kit + CD34 + CD16 / 32 mid
- Progenitor de granulocitos y macrófagos (GMP) : lin - SCA-1 - c-kit + CD34 + CD16 / 32 hi
- Progenitor de los megacariocitos-eritroides (MEP) : lin - SCA-1 - c-kit + CD34 - CD16 / 32 bajo
Para HSCs, CD150 + CD48 - fue suficiente en lugar de CD150 + CD48 - CD244 - porque CD48 es un ligando para CD244, y ambos serían positivos solo en los progenitores de linaje activado activados. Parece que este código era más eficiente que el conjunto anterior más tedioso de la gran cantidad de marcadores, y también se conservan en las cepas del ratón; sin embargo, trabajos recientes han demostrado que este método excluye un gran número de HSC e incluye un número igualmente grande de células no madre. [22] [23] CD150 + CD48 - dio una pureza de células madre comparable a Thy1 lo SCA-1 +lin - c-kit + en ratones. [24]
LT-HSC / ST-HSC / MPP inicial / MPP tardío [ editar ]
El grupo de Irving Weissman en la Universidad de Stanford fue el primero en aislar células madre hematopoyéticas de ratón en 1988 Plantilla: Purificación y caracterización de células madre hematopoyéticas de ratón. y también fue el primero en elaborar los marcadores para distinguir las células madre hematopoyéticas a largo plazo (LT-HSC) y a corto plazo (ST-HSC) (con capacidad de auto renovación) y los progenitores Multipotentes (MPP, bajo). o no hay capacidad de autorrenovación: cuanto más avanzada sea la etapa de desarrollo de MPP, menor será la capacidad de autorrenovación y más de algunos de los marcadores como CD4 y CD135 ):
- LT-HSC : CD34 - , CD38 - , SCA-1 + , Thy1.1 + / lo , C-kit + , lin - , CD135 - , Slamf1 / CD150 +
- ST-HSC : CD34 + , CD38 + , SCA-1 + , Thy1.1 + / lo , C-kit + , lin - , CD135 - , Slamf1 / CD150 + , Mac-1 (CD11b) lo
- MPP Early : CD34 + , SCA-1 + , Thy1.1 - , C-kit + , lin - , CD135 + , Slamf1 / CD150 - , Mac-1 (CD11b) lo , CD4 lo
- Late MPP : CD34 + , SCA-1 + , Thy1.1 - , C-kit + , lin - , CD135 alta , Slamf1 / CD150 - , Mac-1 (CD11b) lo , CD4 lo
Desarrollo [ editar ]
Descendientes [ editar ]
Entre 1948 y 1950, el Comité para la clarificación de la nomenclatura de las células y enfermedades de la sangre y los órganos formadores de sangre emitió informes sobre la nomenclatura de las células sanguíneas. [25] [26] A continuación se muestra una descripción general de la terminología, desde la etapa más temprana hasta la etapa final de desarrollo:
- [raíz] explosión
- pro [root] cyte
- [raíz] cyte
- meta [root] cyte
- nombre celular maduro
La raíz de las unidades formadoras de colonias de eritrocitos (CFU-E) es "rubri", para las unidades formadoras de colonias de monocitos y granulocitos (CFU-GM) es "granulo" o "myelo" y "mono", para las unidades formadoras de colonias de linfocitos (CFU-L) es "linfo" y para las unidades formadoras de colonias de megacariocitos (CFU-Meg) es "megakaryo". De acuerdo con esta terminología, las etapas de la formación de glóbulos rojos serían: rubriblasto, prorubricyte, rubricyte, metarubricyte, and erythrocyte. Sin embargo, la siguiente nomenclatura parece ser, en la actualidad, la más prevalente:
| Comité | linfo | rubri | "granulo" o "myelo" | "mono" | "megakaryo" |
|---|---|---|---|---|---|
| Linaje | Linfoide | Mieloide | Mieloide | Mieloide | Mieloide |
| UFC | CFU-L | CFU-GEMM →CFU-E | CFU-GEMM → CFU-GM→ CFU-G | CFU-GEMM →CFU-GM →CFU-M | CFU-GEMM →CFU-Meg |
| Proceso | linfocitopoyesis | eritropoyesis | granulocitopoyesis | monocitopoyesis | trombocitopoyesis |
| [raíz] explosión | Linfoblasto | Proerythroblast | Mieloblasto | Monoblast | Megacarioblasto |
| pro [root] cyte | Prolinfocito | Eritrocito policromatofilico | Promielocito | Promonocito | Promegakaryocyte |
| [raíz] cyte | - | Normoblast | Eosino / neutro /mielocito basofílico | Megacariocito | |
| meta [root] cyte | Linfocitogrande | Reticulocito | Eosinofílica / neutrofílica / basófilo metamielocito , eosinofílica / neutrofílica / basófilo celular de venda | Monocitos tempranos | - |
| nombre celular maduro | Pequeñolinfocito | Eritrocito | granulocitos ( Eosino /neutro / basófilo ) | Monocitos | trombocitos (plaquetas ) |
Los osteoclastos también surgen de células hemopoyéticas del linaje monocito / neutrófilo, específicamente CFU-GM.
Unidades formadoras de colonias [ editar ]
En el contexto de las células madre hematopoyéticas, una unidad formadora de colonias es un subtipo de HSC. (Este sentido del término es diferente de las unidades de microbios formadoras de colonias , que es una unidad de conteo de células ). Hay varios tipos de unidades formadoras de colonias de HSC:
- Unidad formadora de colonias - granulocitos - eritrocitos - monocitos - megacariocitos ( CFU-GEMM )
- Unidad formadora de colonias - linfocitos ( CFU-L )
- Unidad de formación de colonias: eritrocitos ( CFU-E )
- Unidad de formación de colonias - granulocitos - macrófagos ( CFU-GM )
- Unidad formadora de colonias: megacariocitos ( UFC-Meg )
- Unidad formadora de colonias - basófilos (CFU-B)
- Unidad formadora de colonias - eosinófilos ( CFU-Eos )
Los CFU anteriores se basan en el linaje. Otra CFU, la unidad formadora de colonias: el bazo (CFU-S), fue la base de una formación de colonias clonales in vivo , que depende de la capacidad de las células de médula ósea infundidas para dar lugar a clones de células hematopoyéticas en proceso de maduración en los bazos de Ratones irradiados después de 8 a 12 días. Se usó ampliamente en estudios iniciales, pero ahora se considera que mide células progenitoras o de amplificación de tránsito más maduras en lugar de células madre.
Daño en el ADN con el envejecimiento [ editar ]
Las roturas de la cadena de ADN se acumulan en las HSC a largo plazo durante el envejecimiento. [27] Esta acumulación está asociada con una amplia atenuación de la reparación del ADN y las vías de respuesta que dependen de la quiescencia del HSC. [27] La unión final no homóloga (NHEJ) es una vía que repara las roturas de doble cadena en el ADN. NHEJ se conoce como "no homólogo" porque los extremos de ruptura están ligados directamente sin la necesidad de una plantilla homóloga. La ruta de NHEJ depende de varias proteínas, incluidas la ligasa 4 , la ADN polimerasa mu y el factor 1 de NHEJ (NHEJ1, también conocido como Cernunnos o XLF).
La ADN ligasa 4 (Lig4) tiene un papel altamente específico en la reparación de roturas de doble cadena por parte de NHEJ. La deficiencia de Lig4 en el ratón provoca una pérdida progresiva de HSC durante el envejecimiento. [28] La deficiencia de lig4 en células madre pluripotentes da como resultado la acumulación de roturas de doble hebra de ADN y una mayor apoptosis. [29]
En ratones mutantes de polimerasa mu, el desarrollo de células hematopoyéticas es defectuoso en varias poblaciones de células periféricas y de médula ósea con una disminución de alrededor del 40% en el número de células de la médula ósea que incluye varios linajes hematopoyéticos. [30] El potencial de expansión de las células progenitoras hematopoyéticas también se reduce. Estas características se correlacionan con una capacidad reducida para reparar las roturas de doble cadena en el tejido hematopoyético.
La deficiencia del factor 1 de NHEJ en ratones conduce al envejecimiento prematuro de las células madre hematopoyéticas, como lo indican varias líneas de evidencia, incluida la evidencia de que la repoblación a largo plazo es defectuosa y empeora con el tiempo. [31] Utilizando un modelo de células madre pluripotentes inducido por el hombre de la deficiencia de NHEJ1, se demostró que el NHEJ1 tiene un papel importante en la promoción de la supervivencia de los progenitores hematopoyéticos primitivos. [32] Estas células deficientes en NHEJ1 poseen una capacidad de reparación mediada por NHEJ1 débil que aparentemente es incapaz de hacer frente a los daños en el ADN inducidos por el estrés fisiológico, el metabolismo normal y la radiación ionizante. [32]
La sensibilidad de las células madre hematopoyéticas a la deficiencia de Lig4, ADN polimerasa mu y NHEJ1 sugiere que la NHEJ es un factor determinante clave de la capacidad de las células madre para mantenerse frente al estrés fisiológico a lo largo del tiempo. [28] Rossi et al. [33] encontraron que el daño al ADN endógeno se acumula con la edad incluso en las HSC de tipo salvaje, y sugirió que la acumulación de daño en el ADN puede ser un importante mecanismo fisiológico del envejecimiento de las células madre.
Función [ editar ]
Naturaleza quiescente [ editar ]
Estar en calma es diferente de no hacer nada, los HSC mantienen la calma y mantienen su naturaleza quiescente. Durante la necesidad de acción, revoca el estado latente y se convierte en un participante activo en el metabolismo del huésped. Estas alteraciones metabólicas que sufre una célula madre durante la proliferación y la inactividad son decisivas, lo que hace que las células sobrevivan en un entorno hipóxico extremo que prevalece en la médula ósea. [34] Este tipo de naturaleza de inactividad en las HSC puede ser la razón para ser / actuar como células madre durante períodos de larga duración, incluso durante toda la vida de un individuo.
Multipotencia y auto-renovación [ editar ]
Las HSC pueden reponer todos los tipos de células sanguíneas (es decir, son multipotentes ) y auto renovarse. Una pequeña cantidad de HSC puede expandirse para generar una gran cantidad de HSC hijas. Este fenómeno se usa en el trasplante de médula ósea , [35] cuando un pequeño número de HSC reconstituye el sistema hematopoyético. Este proceso indica que, luego del trasplante de médula ósea, deben ocurrir divisiones celulares simétricas en dos HSC hijas.
Se piensa que la auto renovación de las células madre ocurre en el nicho de células madre en la médula ósea, y es razonable suponer que las señales clave presentes en este nicho serán importantes para la renovación. [1]Existe un gran interés en los requisitos ambientales y moleculares para la auto renovación del HSC, ya que comprender la capacidad del HSC para reponerse puede eventualmente permitir la generación de poblaciones expandidas de HSC in vitro que se pueden usar terapéuticamente.
Movilidad [ editar ]
Las HSC tienen un mayor potencial que otras células sanguíneas inmaduras para pasar la barrera de la médula ósea y, por lo tanto, pueden viajar en la sangre desde la médula ósea de un hueso a otro hueso. Si se instalan en el timo , que pueden convertirse en células T . En el caso de los fetos y otras hematopoyesis extramedulares , las HSC también pueden asentarse en el hígado o el bazo y desarrollarse.
Esto permite que las HSC sean cosechadas directamente de la sangre.
Importancia clínica [ editar ]
Trasplante de [ editar ]
Investigación [ editar ]
Comportamiento en la cultura [ editar ]
Un ensayo de células formadoras de área de adoquines (CAFC) es un ensayo empírico basado en cultivo celular. Cuando se colocan en un cultivo confluente de la capa de alimentación del estroma , una fracción de HSCs se arrastra entre los huecos (incluso aunque las células del estroma se toquen entre sí) y eventualmente se asientan entre las células del estroma y el sustrato (aquí la superficie del plato) o se atrapan en el Procesos celulares entre las células del estroma. La emperipolesis es el fenómeno in vivo en el que una célula está completamente envuelta en otra (p. Ej., Timocitos en células nodrizas tímicas ); por otro lado, cuando in vitro , las células del linaje linfoide se arrastran debajo de las células tipo enfermera, el proceso se llama pseudoemperipolesis . Este fenómeno similar es más comúnmente conocido en el campo HSC por la terminología de cultivo celular en las células formadoras de áreas de adoquines (CAFC) , lo que significa que las áreas o agrupaciones de células se ven opacas a los adoquines bajo el microscopio de contraste de fase, en comparación con las otras HSC, que son refractiles Esto sucede porque las células que flotan libremente sobre las células del estroma son esféricas y, por lo tanto, refractarias. Sin embargo, las células que se arrastran debajo de las células estromales se aplanan y, por lo tanto, no son refractarias. El mecanismo de la pseudoemperipolesis acaba de salir a la luz. Puede estar mediado por la interacción a través de CXCR4(CD184), el receptor para las quimiocinas CXC (por ejemplo, SDF1).) e integrinas α4β1 . [36]
La cinética de repoblación [ editar ]
Las células madre hematopoyéticas (HSC) no se pueden observar directamente directamente y, por lo tanto, sus comportamientos deben inferirse indirectamente. Los estudios clonales son probablemente la técnica más cercana para los estudios de células individuales in vivo de HSC. Aquí, se utilizan sofisticados métodos experimentales y estadísticos para determinar que, con una alta probabilidad, un único HSC está contenido en un trasplante administrado a un huésped irradiado letalmente. La expansión clonal de esta célula madre se puede observar a lo largo del tiempo al controlar el porcentaje de células tipo donante en la sangre a medida que se reconstituye el huésped. La serie de tiempo resultante se define como la cinética de repoblación del HSC.
Las cinéticas de reconstitución son muy heterogéneas. Sin embargo, al usar la dinámica simbólica , uno puede mostrar que caen en un número limitado de clases. [37] Para probar esto, varios cientos de cinéticas de repoblación experimental de clones Thy-1 lo SCA-1 + lin - c-kit + HSC se tradujeron en secuencias simbólicas al asignar los símbolos "+", "-", "~" siempre que dos mediciones sucesivas del porcentaje de células tipo donante tienen una pendiente positiva, negativa o sin cambios, respectivamente. Mediante el uso de la distancia de Hamming , los patrones de repoblación se sometieron a análisis de conglomerados para obtener 16 grupos distintos de cinética. Para terminar la prueba empírica, laSe utilizó el método Laplace add-one [ aclaración necesaria ]para determinar que la probabilidad de encontrar cinéticas no contenidas en estos 16 grupos es muy pequeña. Por corolario, este resultado muestra que el compartimiento de células madre hematopoyéticas también es heterogéneo por criterios dinámicos.



No hay comentarios:
Publicar un comentario