Una célula presentadora de antígeno ( APC ) o célula accesoria es una célula que muestra el antígeno complejado con complejos de histocompatibilidad principales (MHC) en sus superficies; Este proceso se conoce como presentación de antígeno . Las células T pueden reconocer estos complejos utilizando sus receptores de células T (TCR). Las APC procesan losantígenos y los presentan a las células T.
Casi todos los tipos de células pueden presentar antígeno de alguna manera. Se encuentran en una variedad de tipos de tejidos. Las células profesionales presentadoras de antígenos, que incluyen macrófagos , células B y células dendríticas , presentan antígenos extraños a las células T auxiliares , mientras que otros tipos de células pueden presentar antígenos que se originan dentro de la célula a las células T citotóxicas . Además de la familia de proteínas MHC, la presentación de antígenos se basa en otras moléculas de señalización especializadas en las superficies de APC y células T.
Las células presentadoras de antígenos son vitales para una respuesta inmune adaptativa eficaz , ya que el funcionamiento de las células T citotóxicas y auxiliares depende de las APC. La presentación de antígenos permite la especificidad de la inmunidad adaptativa y puede contribuir a las respuestas inmunitarias contra patógenos tanto intracelulares como extracelulares. También está involucrado en la defensa contra los tumores. Algunas terapias contra el cáncer involucran la creación de APC artificiales para cebar el sistema inmunitario adaptativo para atacar las células malignas.
Tipos y funciones [ editar ]
Las células presentadoras de antígenos se clasifican en dos categorías: profesionales y no profesionales. Aquellos que expresan moléculas MHC de clase II junto con moléculas coestimuladoras y receptores de reconocimiento de patrones a menudo se denominan células profesionales presentadoras de antígenos . [1]Los APC no profesionales expresan moléculas MHC de clase I.
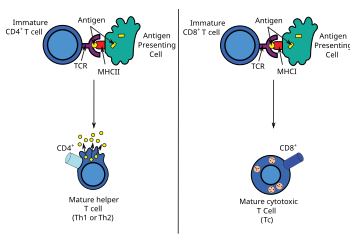
Las células T deben activarse antes de que puedan dividirse y realizar su función. Esto se logra interactuando con una APC profesional que presenta un antígeno reconocido por su receptor de células T. La APC involucrada en la activación de las células T suele ser una célula dendrítica. Las células T no pueden reconocer y, por lo tanto, no pueden responder a antígenos "libres" o solubles. Solo pueden reconocer y responder al antígeno que ha sido procesado y presentado por las células a través de moléculas portadoras como las moléculas MHC. Las células T cooperadoras pueden reconocer el antígeno exógeno presentado en la clase II del MHC; Las células T citotóxicas pueden reconocer el antígeno endógeno presentado en la clase I del MHC. La mayoría de las células en el cuerpo pueden presentar antígeno a la T citotóxica CD8 +células a través de MHC clase I; sin embargo, el término "célula presentadora de antígeno" se usa a menudo específicamente para describir APC profesionales. Estas células expresan las moléculas MHC de clase I y MHC de clase II y pueden estimular las células T auxiliares CD4 +, así como las células T citotóxicas. [2] [3]
Las APC también pueden presentar lípidos extraños y propios para las células T y las células NK mediante el uso de la familia de proteínas CD1 , que son estructuralmente similares a la familia de la clase I del MHC. [4]
Profesional [ editar ]
Los APC profesionales se especializan en presentar antígeno a las células T. [5] Son muy eficientes en la internalización de antígenos, ya sea por fagocitosis (macrófagos y células dendríticas) o por endocitosis mediada por receptores (células B), procesando el antígeno en fragmentos peptídicos y luego mostrando esos péptidos, unidos a una molécula MHC de clase II , en su membrana. [1] La célula T reconoce e interactúa con el complejo de moléculas MHC antígeno-clase II en la membrana de la célula presentadora de antígeno. Luego, la célula presentadora de antígeno produce una señal coestimuladora adicional, lo que lleva a la activación de la célula T. La expresión de moléculas coestimuladoras y MHC clase II son características definitorias de APC profesionales. [1]Todos los APC profesionales también expresan moléculas MHC de clase I también. [2]
Los principales tipos de células presentadoras de antígenos profesionales son las células dendríticas, los macrófagos y las células B. [1]
Las células dendríticas (DCs) [ editar ]
Las células dendríticas tienen el rango más amplio de presentación de antígenos y son necesarias para la activación de células T vírgenes. [1] Las CD presentan antígeno tanto para las células T auxiliares como para las citotóxicas. También pueden realizar una presentación cruzada , un proceso por el cual presentan antígeno exógeno en moléculas de clase I del MHC a células T citotóxicas. La presentación cruzada permite la activación de estas células T. [2] Las células dendríticas también desempeñan un papel en la tolerancia periférica , lo que contribuye a la prevención de enfermedades autoinmunes . [6]
Antes de encontrarse con un antígeno extraño, las células dendríticas expresan niveles muy bajos de MHC de clase II y moléculas coestimuladoras en su superficie celular. Estas células dendríticas inmaduras son ineficaces al presentar antígeno a las células T helper. Una vez que los receptores de reconocimiento de patrones de una célula dendrítica reconocen un patrón molecular asociado a un patógeno, el antígeno se fagocita y la célula dendrítica se activa, aumentando la expresión de las moléculas del MHC de clase II. También regula al alza varias moléculas coestimuladoras necesarias para la activación de las células T, incluidas CD40 y B7. Este último puede interactuar con CD28 en la superficie de una célula T CD4 +. [2] [7] [8]La célula dendrítica es entonces un APC profesional completamente maduro. Se mueve del tejido a los ganglios linfáticos, donde se encuentra y activa las células T. [1]
Macrófagos [ editar ]
Los macrófagos pueden ser estimulados por la secreción de células T del interferón gamma. [9] Después de esta activación, los macrófagos son capaces de expresar MHC de clase II y moléculas coestimuladoras, incluido el complejo B7, y pueden presentar fragmentos de péptidos fagocitados a células T cooperadoras. [7] [8] La activación puede ayudar a los macrófagos infectados con patógenos a eliminar la infección. [10] Derivados de un monocito , tipo de glóbulo blanco , circularán la sangre y entrarán en los sitios afectados y se diferenciarán de los monocitos a los macrófagos. En el sitio afectado, el macrófago rodea el sitio de infección o daño tisular con su membrana en un mecanismo llamado fagocitosis . [11]
Células B [ editar ]
Las células B pueden internalizar el antígeno que se une a su receptor de células B y presentarlo a las células T auxiliares. [1] A diferencia de las células T, las células B pueden reconocer el antígeno soluble para el cual su receptor de células B es específico. Luego, pueden procesar el antígeno y presentar péptidos utilizando moléculas MHC de clase II. Cuando se une una célula T auxiliar con un TCR específico para ese péptido, el marcador de células B CD40 se une a CD40L en la superficie de las células T. Cuando es activada por una célula T, una célula B puede sufrir un cambio de isotipo de anticuerpo, maduración de afinidad, así como formación de células de memoria. [2]
No profesional [ editar ]
Las células presentadoras de antígenos no profesionales incluyen todos los tipos de células nucleadas en el cuerpo. Usan una molécula MHC de clase I acoplada a la microglobulina beta-2 para mostrar péptidos endógenos en la membrana celular. Estos péptidos se originan dentro de la propia célula, en contraste con el antígeno exógeno mostrado por las APC profesionales que utilizan moléculas MHC de clase II. Las células T citotóxicas son capaces de interactuar con el antígeno endógeno presentado utilizando una molécula MHC de clase I. [2]Las APC no profesionales no expresan típicamente moléculas MHC de clase II. Sin embargo, se ha observado que la presentación de antígenos a células CD4 + a través de MHC clase II no está restringida a las APC clásicamente profesionales. Se puede inducir a otros leucocitos, incluidos los granulocitos, como los mastocitos y los neutrófilos, a hacerlo, al igual que las células endoteliales y epiteliales en ciertas circunstancias. Aun así, hay poca evidencia de que estas APC atípicas sean capaces de activar células T CD4 + ingenuas. [1]
Interacción con células T [ editar ]
Después de que las células dendríticas tienen patógenos fagocitados, generalmente migran a la vasta red de vasos linfáticos y son transportadas por el flujo linfático a los ganglios linfáticos que drenan . Cada ganglio linfático es un punto de recolección donde las APC pueden interactuar con las células T. [1] Durante la migración, las CD se someten a un proceso de maduración: pierden la mayor parte de su capacidad para engullir patógenos y maduran al cambiar la expresión superficial de MHC y las moléculas coestimulantes, así como una mayor producción de citoquinas. El antígeno internalizado se digiere en péptidos más pequeños que contienen epítopos, que luego se presentan a las células T por el MHC. [2] [12]
Las células B residen en el ganglio linfático. Una vez que su receptor de células B se une a un antígeno, pueden interactuar con las células T auxiliares activadas, como se describió anteriormente.
Una célula dendrítica que interactúa con una célula T auxiliar ya activada puede obtener una licencia. Esto ocurre a través de la interacción de moléculas coestimuladoras, incluidas B7 y CD40 en la célula dendrítica, con CD28 y ligando CD40 en la célula T. Sólo las células dendríticas autorizadas pueden activar las células T citotóxicas. La licencia de células T de las células dendríticas es clave para la activación de las células T citotóxicas para muchos patógenos, aunque la medida en que se necesita la ayuda de las células T puede variar. [13]
En las moléculas MHC de clase I y clase II, solo se pueden presentar ciertos epítopos de un péptido internalizado. Estos epítopos se denominan inmunodominantes. [14]
En la terapia del cáncer [ editar ]
Las APC, naturalmente, desempeñan un papel en la lucha contra los tumores, a través de la estimulación de las células T B y citotóxicas para producir, respectivamente, anticuerpos contra el antígeno relacionado con el tumor y matar las células malignas. Las células dendríticas, que presentan antígeno específico del tumor a las células T, son clave para este proceso. Las terapias contra el cáncer han incluido el tratamiento del paciente con un mayor número de células dendríticas o células T específicas del cáncer. Sin embargo, las terapias más nuevas han recurrido a células presentadoras de antígenos artificiales diseñadas genéticamente para cebar el sistema inmunológico y atacar a las células malignas. Algunas APC artificiales se derivan de células humanas; otros son acelulares, que contienen proteínas MHC, moléculas coestimuladoras y los péptidos necesarios. [15] [16]
El activador de APC IMP321 se está probando en ensayos clínicos [17] [18] para acelerar la reacción inmune para eliminar el cáncer de mama metastásico o el melanoma.
Las células presentadoras de antígenos artificiales (aAPC) son una nueva tecnología y enfoque para la inmunoterapia del cáncer . La inmunoterapia tiene como objetivo utilizar el propio mecanismo de defensa del cuerpo, el sistema inmunitario, para reconocer las células cancerosas mutadas y matarlos de la forma en que el sistema inmunitario reconocería y mataría a un virus . Las células presentadoras de antígenos son los centinelas del sistema inmunológico y patrullan el cuerpo en busca de agentes patógenos . Cuando se encuentran con patógenos extraños, las células presentadoras de antígenos alertan a las células T- “los soldados del sistema inmunológico”: hay algo extraño en el cuerpo con moléculas específicas de la superficie celular. Las aAPC son versiones sintéticas de estas células centinelas y se crean uniendo las señales estimulantes de células T específicas a varias superficies macro y micro biocompatibles. Esto puede reducir potencialmente el costo al tiempo que permite el control sobre la generación de grandes cantidades de células T funcionales específicas de patógenos para la terapia. Las células T activadas y estimuladas pueden estudiarse en este contexto biomimético y usarse para la transferencia adoptiva como inmunoterapia .
Componentes esenciales de un aAPC [ editar ]
Señal 1 [ editar ]
Modelados después de las APC, las aAPCs necesitan tener al menos dos señales para estimular las células T específicas de antígeno. La primera señal es el principal complejo de histocompatibilidad (MHC), que en los humanos también se conoce como el antígeno leucocitario humano (HLA). Esta es la molécula que está cargada con el antígeno específico. El MHC clase I se encuentra en todas las células y estimula las células T citotóxicas ( células CD8), y el MHC clase II se encuentra en las APC y estimula las células T auxiliares (células CD4). Es el antígeno o epítopo específico que se carga en el MHC determina la especificidad del antígeno. El MHC cargado de péptidos se engancha con el receptor de células T cognado (TCR) que se encuentra en las células T.
Señal 2 [ editar ]
Las células T necesitan otra señal para activarse además de la Señal 1, esto se realiza mediante moléculas coestimuladoras como las proteínas CD80 (B7.1) o CD86 (B7.2), aunque se han identificado otras moléculas adicionales de coestimulación. . Cuando la Señal 2 no se expresa, pero las células T reciben la Señal 1, las células T específicas del antígeno se vuelven anérgicas y no realizan la función efectora.
Señal 3 [ editar ]
La señal 3 es la secreción de APC de citoquinas estimulantes como la IL-2 que aumenta la estimulación de las células T, aunque esto no es necesario para la activación de las células T.
Tipos de aAPCs [ editar ]
Las aAPC basadas en células se han producido mediante la transfección de fibroblastos murinos para expresar moléculas de HLA cargadas con péptidos específicos con la señal coestimuladora B7.1 y las moléculas de adhesión celular ICAM-1 y LFA-3 . [1]
Muchos sistemas de micropartículas se han desarrollado ya que las micropartículas representan tamaños fisiológicamente similares a las células. También se ha demostrado que la curvatura y la forma de las micropartículas desempeñan un papel importante en la estimulación efectiva de las células T. [2]
También se han utilizado nanopartículas . Las nanopartículas tienen la ventaja adicional de un transporte mejorado una vez que se inyectan en el cuerpo en comparación con las micropartículas. Las nanopartículas pueden ser transportadas a través de la matriz extracelular porosa mucho más fácil y llegar a los ganglios linfáticos donde residen las células T. [3] Además, las nanopartículas de óxido de hierro se han utilizado para aprovechar las propiedades superparamagnéticas y agrupar ambas señales para mejorar la estimulación de las células T. [4]
Los materiales que se han usado incluyen poli (ácido glicólico) , poli (ácido láctico-co-glicólico) , óxido de hierro , liposomas , bicapas lipídicas , sefarosa , poliestireno y poliisocianopéptidos . [5]
Usos [ editar ]
Las aAPC eliminan la necesidad de recolectar APC específicas del paciente, como las células dendríticas (DC) y el proceso de activación de las DC en la estimulación de las células T específicas del antígeno. A medida que se han descubierto antígenos específicos del cáncer, estos antígenos se pueden cargar en aAPC para estimular y expandir con éxito las células T citotóxicas específicas del tumor. Estas células T se pueden volver a infundir o transferir de manera adoptiva al paciente para una terapia eficaz contra el cáncer. Esta tecnología se está probando actualmente en laboratorios para su uso potencial en la terapia del cáncer y para estudiar los mecanismos de señalización de APC endógena.

No hay comentarios:
Publicar un comentario