Las células de Langerhans son células dendríticas ( células inmunes que presentan antígenos ) de la piel y contienen orgánulosllamados gránulos de Birbeck . Están presentes en todas las capas de la epidermis y son más prominentes en el estrato espinoso . [2]También se presentan en la dermis papilar , particularmente alrededor de los vasos sanguíneos, [2] , así como en la mucosa de la boca , el prepucio y el epitelio vaginal . [3] Se pueden encontrar en otros tejidos, como los ganglios linfáticos., particularmente en asociación con la condición de histiocitosis de células de Langerhans (HCL).
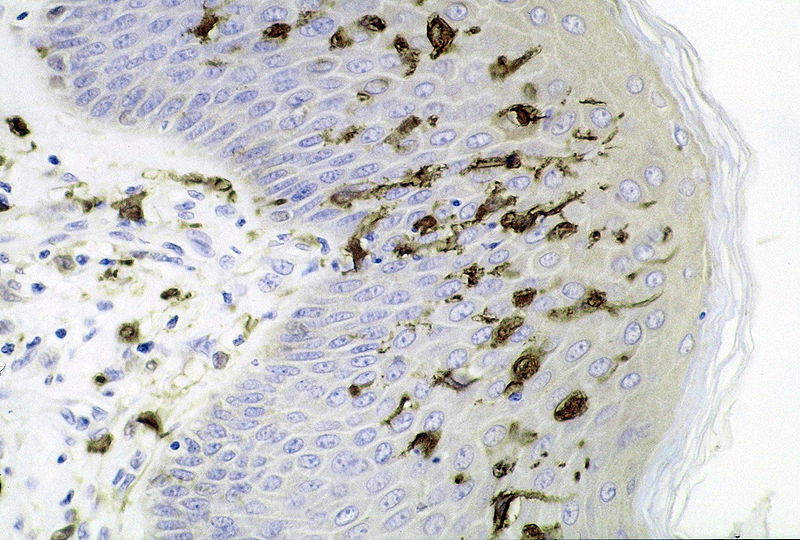
Sección de la piel que muestra un gran número de células dendríticas (Langerhans) en la epidermis. Infección por M. ulcerans , tinción con inmunoperoxidasa S100.
Función [ editar ]
En las infecciones de la piel , las células locales de Langerhans absorben y procesan los antígenos microbianospara que se conviertan en células presentadoras de antígenos totalmente funcionales .
En general, las células dendríticas en el tejido son activas en la captura, captación y procesamiento de antígenos. Sin embargo, una vez que las células dendríticas llegan al tejido linfoide secundario, pierden estas propiedades y adquieren la capacidad de interactuar con las células T vírgenes .
Las células de Langerhans se derivan de progenitores eritro-mieloides primitivos que surgen en el saco vitelino fuera del embrión en el primer trimestre del embarazo, y en circunstancias normales persisten durante toda la vida, y la proliferación local las repone según sea necesario. Si la piel se inflama severamente, tal vez debido a una infección, los monocitos de sangre se reclutan en la región afectada y se diferencian en LC de reemplazo. [4] Son similares en morfología y función a los macrófagos .
Langerin es una proteína que se encuentra en las células de Langerhans, [5] y otros tipos de células dendríticas . [6]
Importancia clínica [ editar ]
LCH [ editar ]
En la enfermedad rara, la histiocitosis de células de Langerhans (HCL), se produce un exceso de células similares a estas células. Sin embargo, las células de la HCL se tiñen de forma positiva a CD14, que es un marcador de monocitos y muestra un origen hematopoyético diferente para el trastorno. [7] La HCL puede causar daños en la piel , los huesos y otros órganos.
VIH [ editar ]
Las células de Langerhans pueden ser objetivos celulares iniciales en la transmisión sexual del VIH, [8] y pueden ser un objetivo, reservorio y vector de diseminación. [9]
Se han observado células de Langerhans en la mucosa del prepucio, vaginal y oral de los humanos; las concentraciones más bajas en la mucosa oral sugieren que no es una fuente probable de infección por VIH enrelación con el prepucio y la mucosa vaginal. [3]
El 4 de marzo de 2007, la revista en línea Nature Medicine publicó la carta de investigación " Langerin es una barrera natural para la transmisión del VIH-1 por las células de Langerhans". [10] Uno de los autores del estudio, Teunis Geijtenbeek, dijo que "Langerin es capaz de eliminar los virus del ambiente circundante, previniendo así la infección" y "ya que generalmente todos los tejidos en el exterior de nuestros cuerpos tienen células de Langerhans, pensamos que el cuerpo humano está equipado con un mecanismo de defensa antiviral, que destruye los virus entrantes ". [11]
HPV [ editar ]
Los virus del papiloma humano de alto riesgo (VPH) son virus de transmisión sexual asociados causalmente con varios tipos de cáncer, incluidos los cánceres cervical, vaginal, anal y de cabeza y cuello que causan una morbilidad y mortalidad significativas en todo el mundo. [12] [13] [14] [15] Más de la mitad de todos los casos de cáncer cervical están asociados con HPV16, el genotipo más común de alto riesgo que causa cáncer. [16]Durante su ciclo vital natural, el VPH16 infecta las células basales del epitelio e interactúa con las células de Langerhans dentro de la capa epitelial, [17] que son responsables de iniciar respuestas inmunitarias contra patógenos invasores epiteliales. [18]Sin embargo, el VPH no activa las células de Langerhans in vitro , y esto puede representar un mecanismo clave por el cual el VPH evade la detección inmune in vivo . [19] [20] [21] [22]Específicamente, la entrada de HPV16 en las células de Langerhans a través del heterotetrámero anexina A2 / S100A10 da como resultado una señalización supresora y la falta de respuestas inmunes mediadas por células de Langerhans. [23] Este mecanismo de escape inmune dirigido por células de Langerhans parece estar conservado entre diferentes genotipos de HPV, lo que permite que estos virus permanezcan sin ser detectados en ausencia de otros eventos inflamatorios. [24]Las células T expuestas a estas células de Langerhans inactivadas no son anérgicas y pueden activarse contra el VPH al recibir los estímulos apropiados en un momento posterior. [25]
Se demostró que las células de Langerhans en lesiones cervicales inducidas por HPV eran esféricas, carecían de dendritas y secretaban la citocina supresora IL-10 in vivo . [26] Los autores demostraron además que el número de células de Langerhans inmunosupresoras secretoras de IL-10 , y la cantidad de IL-10 producida en las lesiones, se correspondían con la gravedad de la histopatología y la carga viral del VPH, lo que proporciona evidencia de un mecanismo inmunosupresor activo empleado por VPH que se dirige a las células de Langerhans en vivo .
Historia [ editar ]
La célula de Langerhans lleva el nombre de Paul Langerhans , un médico y anatomista alemán , quien descubrió las células a la edad de 21 años cuando era estudiante de medicina . [27] Debido a su naturaleza dendrítica, identificó erróneamente las células como parte del sistema nervioso .
Las células epiteliales del timo medular ( mTEC ) representan una población única de células estromales del timo que desempeña un papel esencial en el establecimiento de la tolerancia central . Por lo tanto, los mTEC se clasifican entre las células relevantes para el desarrollo del sistema inmune de mamíferos funcionales .
Los precursores de células T aumentan en la médula ósea y migran a través del torrente sanguíneo hacia el timo para un mayor desarrollo. Durante su maduración en el timo, se someten a un proceso llamado recombinación V (D) J que conduce al desarrollo de receptores de células T (TCR). El mecanismo de este proceso estocástico permite, por un lado, la generación de un vasto repertorio de TCR, sin embargo, por otro lado, también causa el origen de las llamadas "células T autorreactivas" que reconocen los antígenos propios a través de sus TCR. Las células T autorreactivas deben eliminarse del cuerpo o sesgarse en el linaje de células reguladoras T (TRegs) para prevenir las manifestaciones de autoinmunidad. Los mTEC poseen la capacidad de tratar con estos clones autorreactivos a través de la mediación de los procesos de tolerancia central, es decir, la eliminación clonal o la selección de células T reguladoras , respectivamente.
La generación de auto-antígenos y presentación [ editar ]
En 1989, dos grupos científicos presentaron la hipótesis de que el timo expresa genes que se encuentran en la periferia, expresados estrictamente por tejidos específicos ( p. Ej., Insulina producida por las células β del páncreas ) para presentar posteriormente los llamados " antígenos restringidos a tejidos ". "(TRA) desde casi todas las partes del cuerpo hasta las células T en desarrollo para probar qué TCR reconocen los tejidos propios y, por lo tanto, pueden ser perjudiciales para el cuerpo. [1] Se descubrió, después de más de una década, que este fenómeno es manejado específicamente por los mTEC en el timo y se denominó expresión génica promiscua (PGE). [2]
Regulador autoinmune [ editar ]
El único controlador conocido de PGE es una proteína llamada regulador autoinmune (Aire) que también se expresa específicamente mediante mTEC. [3] y su expresión es completamente dependiente de la vía de señalización de NF-kappa B . [4] Aire reconoce los genes diana de TRA a través de marcas de metilación específicas [5] [6] y requiere aproximadamente 50 moléculas asociadas para la activación de su expresión. [7]Además, la activación dependiente de Aire de la expresión de los genes TRA se acompaña de la formación de roturas de doble cadena del ADN. [8] que probablemente tenga como resultado una vida útil muy corta de los mTEC entre 2 y 3 días [9]
Las mutaciones del gen Aire en humanos causan un raro trastorno autoinmune llamado Poliendocrinopatía autoinmune Candidiasis Distrofia ectodérmica (APECED)., [10] [11] que generalmente se manifiesta en combinación con otras enfermedades autoinmunes, por ejemplo: diabetes mellitus tipo 1 . La disfunción del gen Aire murino da como resultado un escenario comparable y, por lo tanto, se utiliza el ratón como organismo modelo para la investigación de APECED.
mTECs en numeros [ editar ]
Los mTEC como población son capaces de expresar más de 19000 genes (aproximadamente el 80% del genoma del ratón), de los cuales aproximadamente 4000 pertenecen a las TRA dependientes de Aire. Es importante destacar que el mTEC único expresa aproximadamente 150 TRA dependientes de Aire y aproximadamente 600 TRA independientes, [12] lo que indica que existen otros reguladores de PGE aún desconocidos. De hecho, se sugirió que otra proteína llamada Fezf2 es el segundo regulador de PGE. [13]
Se demostró que cada mTEC expresa estocásticamente el 1-3% del conjunto de TRA. [14] Sin embargo, estudios más recientes descubrieron patrones de coexpresión estables entre los genes TRA que se localizan muy cerca, lo que sugiere "orden en este proceso estocástico". [15] [16]
Protección de tejidos contra células T autorreactivas [ editar ]
Los precursores de células T extravasan del torrente sanguíneo en la unión córtico-medular y primero migran a la corteza tímica, donde experimentan la construcción de TCR y, posteriormente, un proceso llamado selección positiva de células T que está mediada por células relacionadas con mTEC: células epiteliales del timo cortical ( cTECs). Este proceso verifica si los TCR recién generados son funcionales. [17] Alrededor del 90% de las células T muestra TCR mal reorganizados, no pueden alcanzar la selección positiva y mueren por negligencia en la corteza. [18] El resto comienza a expresar CCR7, que es un receptor para la quimiocina CCL21 generada por mTEC, y migra después del gradiente de concentración a la médula tímica para encontrar mTEC. [19]
Dos modos de tolerancia central [ editar ]
Los mTEC no son solo mediadores de PGE y "fábricas de TRA". También expresan altos niveles de MHC II y las moléculas coestimuladoras CD80 / CD86 y se clasifican entre las células eficientes presentadoras de antígeno(APC). [2] Además, utilizan macroautofagia para cargar autoantígenos en moléculas MHCII. [20] Por lo tanto, los mTEC son capaces de presentar TRA autogenerados en sus moléculas MHC para seleccionar posibles células T autorreactivas. Se publicó que los mTEC median en la eliminación clonal ( tolerancia recesiva ), a través de la presentación de las TRA, lo que conduce a la apoptosis de las células T autorreactivas, [21] [22] [23]además de ser competentes para sesgar células T autorreactivas en TRegs, también a través de la presentación de TRA, que luego migran a la periferia para proteger tejidos contra células T autorreactivas que ocasionalmente evitan procesos de selección en el timo ( tolerancia dominante ). [24] [25]
¿Cómo mTECs discriminan entre estos dos modos de tolerancia? Se demostró que los posibles TReg interactúan con las TRA presentadas con una afinidad más baja que las que se eliminan por clonación. [17]Además, también se reveló que las TRA específicas desvían las células T autorreactivas a las TReg con una eficiencia mucho mayor que en el caso de la eliminación clonal. [26]
Transferencia de antígeno en el timo [ editar ]
Los mTEC forman una población rara que se compone de aproximadamente 100000 células por timo de ratones de 2 semanas de edad. [27] Por lo tanto, hay una baja probabilidad de encuentro entre las células T autorreactivas y mTEC. La transferencia de antígenos unidireccional de mTEC a células dendríticas (DC) tímicas , que a su vez no puede expresar TRA, extiende la red de presentación de TRA, permite el procesamiento de TRA por diferentes microambientes y aumenta la probabilidad de encuentro entre las células T autorreactivas y su autoantígeno apropiado . [28] [29] [30] Además, los CD inducen de manera competente tanto la tolerancia recesiva y dominante como los mTEC. [29]
En contraste, otro estudio seminal revela que los mTEC son suficientes para establecer una tolerancia tanto recesiva como dominante sin la ayuda de APC adicionales. [31]
Desarrollo [ editar ]
Subconjuntos [ editar ]
La población de mTEC no es homogénea y básicamente podría subdividirse en una población más numerosa de mTEC que expresan un número bajo de MHCII y CD80 / CD86, es decir, mTECs Lo y una población más pequeña de mTECs Hi que expresan mayores cantidades de estas moléculas. [32] El regulador de PGE Aire se expresa solo por parte de los mTECs Hi . [9] Sin embargo, esta afirmación no significa que los mTECs Lo no contribuyan a PGE, los mTECs Hola , especialmente que expresar Aire, son mucho más eficientes en este proceso. [32]
Existe evidencia de que los mTECs Lo sirven como precursores de los mTECs Hi en el timo embrionario [33] [34]Sin embargo, la situación cambia después del nacimiento, donde solo una parte de los mTECs Lo representa un inmaduro mTECs Hi reservoir [33] y otra parte está constituida por mTECs maduros que se especializan para la expresión de quimiocina CCL21, [35] discutido anteriormente. Un subconjunto adicional de mTECs Lo pool está formado por células diferenciadas de forma terminal llamadas mTEC Post-Aire que ya regulaban la expresión de Aire, MHCII y CD80 / CD86. [36]
Células progenitoras [ editar ]
Los TEC (mTECs y cTECs) se originan a partir de la tercera bolsa faríngea que es un producto de endodermo . [37] Su origen común apunta al hecho de que tanto los mTEC como los cTEC se elevan desde un progenitorbipotente . Esta noción fue confirmada por varios estudios de timo embrionario. [38] [39] y se desarrolló aún más al encontrar que estos progenitores bipotentes expresan marcadores cTEC. [40] [41] Sin embargo, otras fuentes documentan la existencia de progenitores unipotentes mTEC que expresan la claudina 3 y 4 (Cld3 / 4). [42] [43]Estos dos hallazgos opuestos se interconectaron mediante la observación de progenitores de mTEC unipotentes en el timo postnatal que expresaron previamente marcadores de cTEC y expresaron simultáneamente Cld3 / 4. [44] Por otro lado, varios otros estudios describen la aparición de progenitores bipotentes en el timo posnatal. [45] [46] [47] [48] Por lo tanto, el timo embrionario y postnatal podría albergar tanto a los progenitores mTEC bipotentes como TEC o bipotentes.
De manera similar a la expresión de Aire, el desarrollo de mTEC es altamente dependiente de la ruta de señalización NF-kappa B.
No hay comentarios:
Publicar un comentario