La migración celular es un proceso central en el desarrollo y mantenimiento de organismos multicelulares . La formación de tejidos durante el desarrollo embrionario , la cicatrización de heridas y las respuestas inmunesrequieren el movimiento orquestado de las células en direcciones particulares hacia ubicaciones específicas. Las células a menudo migran en respuesta a señales externas específicas, incluidas señales químicas y señales mecánicas . [1] Los errores durante este proceso tienen consecuencias graves, como discapacidad intelectual , enfermedad vascular , formación de tumores y metástasis. Una comprensión del mecanismo por el cual las células migran puede llevar al desarrollo de nuevas estrategias terapéuticas para controlar, por ejemplo, las células tumorales invasivas.
Debido al entorno altamente viscoso (bajo número de Reynolds ), las células necesitan producir fuerzas de manera permanente para poder moverse. Las células logran el movimiento activo por mecanismos muy diferentes. Muchos organismos procarióticos (y células espermáticas) menos complejos utilizan flagelos o ciliospara impulsarse a sí mismos. La migración de células eucariotas es típicamente mucho más compleja y puede consistir en combinaciones de diferentes mecanismos de migración. Por lo general, implica cambios drásticos en la forma celular que son impulsados por el citoesqueleto . Dos escenarios de migración muy distintos son el movimiento de rastreo (el más comúnmente estudiado) y la motilidad de las ampollas. [2] Un ejemplo paradigmático de movimiento de arrastre es el caso de los queratocitos epidérmicos de peces (videomicroscopía de queratocitos de peces epidérmicos cultivados que se arrastran ), que se han utilizado ampliamente en la investigación y la enseñanza.
Estudios de migración celular [ editar ]
La migración de células cultivadas unidas a una superficie se estudia comúnmente mediante microscopía . Como el movimiento de las celdas es muy lento, se graban videos de microscopía de lapso de tiempo de unas pocas micras / minuto de las celdas que migran para acelerar el movimiento. Dichos videos (Figura 1) revelan que el frente de células líder es muy activo, con un comportamiento característico de contracciones y expansiones sucesivas. En general se acepta que el frente principal es el motor principal que empuja la celda hacia adelante.
Características comunes [ editar ]
Se cree que los procesos que subyacen a la migración de células de mamíferos son consistentes con los de la locomoción (no espermatozoica ) . [5] Las observaciones en común incluyen:
- Desplazamiento citoplasmático en el borde de ataque (frente)
- remoción laminar de los desechos acumulados dorsalmente hacia el borde posterior (parte posterior)
La última característica se observa más fácilmente cuando los agregados de una molécula de superficie se entrecruzan con un anticuerpo fluorescente o cuando las pequeñas perlas se unen artificialmente al frente de la célula. [6]
Se observa que otras células eucariotas migran de manera similar. La ameba Dictyostelium discoideum es útil para los investigadores porque exhiben constantemente quimiotaxis en respuesta al AMP cíclico ; se mueven más rápidamente que las células cultivadas de mamíferos; y tienen un genoma haploide que simplifica el proceso de conexión de un producto genético particular con su efecto en el comportamiento celular. [7]
Procesos moleculares de la migración [ editar ]
Hay dos teorías principales sobre cómo la célula avanza su borde frontal: el modelo de citoesqueleto y el modelo de flujo de membrana. Es posible que ambos procesos subyacentes contribuyan a la extensión celular.
Modelo citoesquelético (A) [ editar ]
Borde de ataque [ editar ]
La experimentación ha demostrado que existe una polimerización rápida de la actina en el borde frontal de la célula. [8] Esta observación ha llevado a la hipótesis de que la formación de filamentos de actina "empuja" el borde delantero hacia adelante y es la principal fuerza móvil para avanzar el borde frontal de la célula. [9] [10] Además, los elementos del citoesqueleto son capaces de interactuar de manera extensa e íntima con la membrana plasmática de una célula. [11]
Borde de salida [ editar ]
Otros componentes del citoesqueleto (como los microtúbulos) tienen funciones importantes en la migración celular. Se ha encontrado que los microtúbulos actúan como "puntales" que contrarrestan las fuerzas contráctiles que se necesitan para la retracción del borde trasero durante el movimiento de la célula. Cuando los microtúbulos en el borde posterior de la celda son dinámicos, se pueden remodelar para permitir la retracción. Cuando se suprime la dinámica, los microtúbulos no pueden remodelarse y, por lo tanto, oponerse a las fuerzas contráctiles. [12] La morfología de las células con dinámica de microtúbulos suprimida indica que las células pueden extender el borde frontal (polarizado en la dirección del movimiento), pero tienen dificultades para retraer su borde posterior. [13]Por otro lado, las altas concentraciones de fármaco, o mutaciones de microtúbulos que despolimerizan los microtúbulos, pueden restaurar la migración celular, pero existe una pérdida de direccionalidad. Se puede concluir que los microtúbulos actúan tanto para restringir el movimiento celular como para establecer la direccionalidad.
Modelo de flujo de membrana (B) [ editar ]
Los estudios también han demostrado que el frente de la migración es el sitio en el que la membrana se devuelve a la superficie celular desde los conjuntos de membranas internas al final del ciclo endocítico . [14] Esto ha llevado a la hipótesis de que la extensión del borde de ataque se produce principalmente mediante la adición de una membrana en la parte frontal de la célula. Si es así, los filamentos de actina que se forman en la parte delantera podrían estabilizar la membrana agregada, de modo que se forme una extensión estructurada, o laminilla, en lugar de una estructura similar a una burbuja (o ampolla) en su parte frontal. [15] Para que una célula se mueva, es necesario traer un nuevo suministro de "pies" (proteínas llamadas integrinas, que unen una celda a la superficie sobre la cual se está arrastrando) al frente. Es probable que estos pies se endociten hacia la parte posterior de la célula y se lleven al frente de la célula por exocitosis, para ser reutilizados para formar nuevos accesorios al sustrato.
[ Editar ] Mecanismo biomecánico y molecular colectivo del movimiento celular .
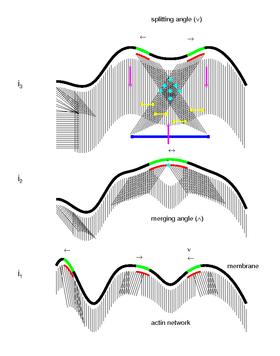
Según algunos modelos matemáticos, estudios recientes plantean la hipótesis de un modelo biológico novedoso para el mecanismo biomecánico y molecular colectivo del movimiento celular. [dieciséis]Se propone que los microdominios tejen la textura del citoesqueleto y sus interacciones marcan la ubicación para la formación de nuevos sitios de adhesión. De acuerdo con este modelo, la dinámica de señalización del microdominio organiza el citoesqueleto y su interacción con el sustrato. A medida que los microdominios activan y mantienen la polimerización activa de los filamentos de actina, su movimiento de propagación y zigzag en la membrana genera una red altamente interconectada de filamentos curvados o lineales orientados en un amplio espectro de ángulos al límite celular. También se propone que la interacción del microdominio marca la formación de nuevos sitios de adhesión focal en la periferia de la célula. La interacción de la miosina con la red de actina genera la retracción / ondulación de la membrana, el flujo retrógrado y las fuerzas contráctiles para el movimiento hacia adelante. Finalmente,
La polaridad en las células que migran [ editar ]
Las células migratorias tienen una polaridad: una parte delantera y otra trasera. Sin él, se moverían en todas las direcciones a la vez, es decir, se extenderían. Se desconoce cómo se formula esta polaridad a nivel molecular dentro de una célula. En una celda que serpentea de forma aleatoria, el frente puede fácilmente dar paso a ser pasivo, ya que otras regiones o regiones de la célula forman un nuevo frente. En las células de quimiotaxación, la estabilidad del frente parece mejorada a medida que la célula avanza hacia una mayor concentración del químico estimulante. Esta polaridad se refleja a nivel molecular mediante una restricción de ciertas moléculas a regiones particulares de la superficie celular interna . Por lo tanto, el fosfolípido PIP3 y el Rac activado y CDC42 se encuentran en la parte frontal de la célula, mientras queRho GTPase y PTEN se encuentran hacia la parte trasera. [17] [18]
Se cree que las actinas filamentosas y los microtúbulos son importantes para establecer y mantener la polaridad de una célula. Los medicamentos que destruyen los filamentos de actina tienen efectos múltiples y complejos, lo que refleja el amplio papel que desempeñan estos filamentos en muchos procesos celulares. Puede ser que, como parte del proceso locomotor, las vesículas de membranaSe transportan a lo largo de estos filamentos al frente de la célula. En las células de quimiotaxización, la mayor persistencia de la migración hacia el objetivo puede resultar de una mayor estabilidad de la disposición de las estructuras filamentosas dentro de la célula y determinar su polaridad. A su vez, estas estructuras filamentosas se pueden organizar dentro de la célula de acuerdo con la forma en que las moléculas como PIP3 y PTEN están dispuestas en la membrana celular interna. Y el lugar donde se ubican estos, a su vez, parece ser determinado por las señales de quimioatrayentes ya que estos inciden en receptores específicos en la superficie externa de la célula.
Aunque se sabe que los microtúbulos influyen en la migración celular durante muchos años, el mecanismo por el cual lo hacen sigue siendo controvertido. En una superficie plana, los microtúbulos no son necesarios para el movimiento, pero se requiere que proporcionen direccionalidad al movimiento de la celda y una protuberancia eficiente del borde de ataque. [13] [19] Cuando están presentes, los microtúbulos retardan el movimiento celular cuando su dinámica se suprime mediante el tratamiento con medicamentos o mediante mutaciones de tubulina. [13]
Los problemas inversos en el contexto de la motilidad celular [ editar ]
En una serie de trabajos recientes, se ha establecido una nueva área de investigación llamada problemas inversos en la motilidad celular. [20] [21] [16] Este enfoque se basa en la idea de que los cambios de comportamiento o de forma de una celda contienen información sobre los mecanismos subyacentes que generan estos cambios. La lectura del movimiento celular, es decir, la comprensión de los procesos biofísicos y mecanoquímicos subyacentes, es de suma importancia. [22] [23] Los modelos matemáticos desarrollados en estos trabajos determinan algunas características físicas y propiedades del material de las células localmente a través del análisis de secuencias de imágenes de células vivas y utilizan esta información para hacer más inferencias sobre las estructuras moleculares, la dinámica y los procesos dentro de las células, como la actina. Red, microdominios, quimiotaxis, adhesión y flujo retrógrado.
El movimiento amoeboide es el modo más común de locomoción en las células eucariotas. [1] Es un tipo de movimiento de arrastre realizado por la protrusión del citoplasma de la célula que involucra la formación de pseudopodios ("pies falsos") y uropodos posteriores . Uno o más pseudopodios pueden producirse a la vez, dependiendo del organismo, pero todo movimiento ameboide se caracteriza por el movimiento de organismos con una forma amorfa que no poseen estructuras de motilidad determinadas. El movimiento se produce cuando el citoplasma se desliza y forma un pseudopodium en el frente para tirar de la célula hacia adelante. Este tipo de movimiento ha sido vinculado a cambios en el potencial de acción., aunque el mecanismo exacto sigue siendo desconocido. Algunos ejemplos de organismos que exhiben este tipo de locomoción son los ameboides , los mohos de limo y algunos protozoos como Naegleria gruberi , [2] , así como algunas células en humanos como los leucocitos . Los sarcomas , o cánceres que surgen de las células del tejido conectivo, son particularmente adeptos al movimiento ameboide, lo que lleva a su alta tasa de metástasis .
Si bien se han propuesto varias hipótesis para explicar el mecanismo del movimiento ameboide, el mecanismo exacto sigue siendo desconocido.
Mecanismo molecular de movimiento celular [ editar ]
Teoría Sol-gel [ editar ]
El protoplasma de una ameba está formado por una capa externa denominada ectoplasma que rodea una porción interna llamada endoplasma . El ectoplasma consiste en un gel de plasma semisólido gelatinoso llamado, mientras que el endoplasma se compone de un líquido menos viscoso llamado sol de plasma. El ectoplasma debe su estado altamente viscoso, en parte, al complejo de actomiosina reticulante que contiene. Se cree que la locomoción de una ameba se produce debido a la conversión sol-gel del protoplasma dentro de su célula. "La conversión sol-gel describe los eventos de contracción y relajación que se aplican por la presión osmótica y otras cargas iónicas". [4]
Por ejemplo, cuando una ameba se mueve, se extiende un pseudopodio gelatinoso, citosólico, que luego da como resultado que el citosol (sol de plasma) más fluido fluya después de la porción de gelatina (gel de plasma) donde se congela al final del pseudopodio. Esto resulta en la extensión de este apéndice. En el extremo opuesto (posterior) de la célula, el gel de plasma se convierte en sol de plasma y se transmite hacia el pseudopodio que avanza. Mientras la célula tenga una forma de agarrar el sustrato , la repetición de este proceso guía a la célula hacia adelante. Dentro de la ameba, hay proteínas que pueden activarse para convertir el gel en el estado de sol más líquido.
El citoplasma consiste en gran parte de actina y la actina está regulada por proteínas que se unen a la actina. Las proteínas de unión a la actina están a su vez reguladas por los iones de calcio; Por lo tanto, los iones de calcio son muy importantes en el proceso de conversión sol-gel. [1] [4]
Modalidades del movimiento ameboide [ editar ]
Actina impulsada por la motilidad [ editar ]
Basados en algunos modelos matemáticos, estudios recientes plantean la hipótesis de un nuevo modelo biológico para los mecanismos colectivos biomecánicos y moleculares del movimiento celular. [5] Se propone que los microdominios tejen la textura del citoesqueleto.y sus interacciones marcan la ubicación para la formación de nuevos sitios de adhesión. Según este modelo, la dinámica de señalización del microdominio organiza el citoesqueleto y su interacción con el sustrato. A medida que los microdominios activan y mantienen la polimerización activa de los filamentos de actina, su movimiento de propagación y zigzag en la membrana genera una red altamente interconectada de filamentos curvados o lineales orientados en un amplio espectro de ángulos al límite celular. También se ha propuesto que la interacción del microdominio marca la formación de nuevos sitios de adhesión focal en la periferia de la célula. La interacción de la miosina con la actina.la red genera la retracción de la membrana / ondulación, el flujo retrógrado y las fuerzas contráctiles para el movimiento hacia adelante. Finalmente, la aplicación continua de estrés en los antiguos sitios de adhesión focal podría resultar en la activación de calpaína inducida por el calcio y, en consecuencia, en el desprendimiento de las adherencias focales que completa el ciclo.
Además de la polimerización de la actina, los microtúbulos también pueden desempeñar un papel importante en la migración celular cuando se trata de la formación de lamellipodia . Un experimento demostró que aunque los microtúbulos no son necesarios para que la polimerización de la actina cree extensiones lamelipodiales, se necesitan para permitir el movimiento celular. [6]
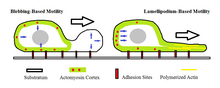
Ampolla impulsada por la motilidad [ editar ]
Otro mecanismo propuesto, el mecanismo de "locomoción ameboide impulsada por ampollas", sugiere que la actomiosina de la corteza celular se contrae para aumentar la presión hidrostática dentro de la célula. El sangrado se produce en células ameboides cuando hay una protuberancia aproximadamente esférica en la membrana celular caracterizada por desprendimiento de la corteza de actomiosina. Este modo de movimiento amoeboide requiere que la miosina II desempeñe un papel en la generación de la presión hidrostática que hace que la ampolla se extienda. [7] Esto es diferente de la locomoción impulsada por actina, donde la protuberancia creada es por la polimerización de la actina mientras permanece unida a la corteza de actomiosina y se empuja físicamente contra la barrera de la célula. Durante el movimiento ameboide impulsado por ampollas, se regula el estado de sol-gel citoplásmico. [1]
También se ha observado que las ampollas formadas por las células móviles experimentan un ciclo de vida aproximadamente uniforme que dura aproximadamente un minuto. Esto incluye una fase que involucra la expansión hacia afuera inicial donde la membrana se separa del citoesqueleto membranoso. Luego sigue una breve fase estática en la que la presión hidrostática que se acumula es suficiente para mantener el tamaño de la ampolla. Después de esto, se encuentra la última fase caracterizada por el retroceso lento de la ampolla y la reintroducción de la membrana en la infraestructura del citoesqueleto. [9]
Las células pueden sufrir transiciones rápidas entre la motilación y la motilidad basada en lamellipodium como un medio de migración. Sin embargo, todavía se desconoce la velocidad a la que se realizan estas transiciones. Las células tumorales también pueden mostrar transiciones rápidas entre la motilidad ameboide y la motilidad mesenquimatosa, otra forma de movimiento celular. [10]
Mecanismos de movimiento relacionados [ editar ]
Las células de dictyostelium y los neutrófilos también pueden nadar, utilizando un mecanismo similar al del rastreo. [11] [12]



No hay comentarios:
Publicar un comentario