El sistema 10-20 o el sistema internacional 10-20 es un método reconocido internacionalmente para describir y aplicar la ubicación de los electrodos del cuero cabelludo en el contexto de un examen EEG , un estudio de sueñopolisomnográfico o una investigación de laboratorio voluntaria. Este método se desarrolló para mantener métodos de prueba estandarizados que aseguren que los resultados del estudio (clínico o de investigación) de un sujeto puedan compilarse, reproducirse, analizarse y compararse de manera efectiva utilizando el método científico . El sistema se basa en la relación entre la ubicación de un electrodo y el área subyacente del cerebro, específicamente la corteza cerebral .
Durante los ciclos de sueño y vigilia, el cerebro produce diferentes patrones eléctricos, reconocidos objetivamente y distinguibles, que pueden ser detectados por electrodos en la piel. (Estos patrones pueden variar y pueden verse afectados por múltiples factores extrínsecos, es decir, edad, medicamentos recetados, diagnósticos somáticos, hx de lesiones / traumas / traumatismos neurológicos y abuso de sustancias)
El "10" y el "20" se refieren al hecho de que las distancias reales entre los electrodos adyacentes son el 10% o el 20% de la distancia total entre la parte delantera y trasera o la derecha-izquierda del cráneo. Por ejemplo, una medida se toma en la parte superior de la cabeza, desde el nasion hasta el inion . La mayoría de las otras medidas comunes ('métodos de marcado de puntos') comienzan en una oreja y terminan en la otra, normalmente en la parte superior de la cabeza. Las ubicaciones anatómicas específicas de la oreja utilizadas incluyen el trago, la aurícula y el mastoideo .

Ubicaciones de electrodos del sistema internacional 10-20 para el registro de EEG (electroencefalografía)
Etiquetado de electrodos [ editar ]
Cada sitio de colocación de electrodos tiene una letra para identificar el lóbulo o el área del cerebro desde donde se lee: Prefrontal (Fp), Frontal (F), Temporal (T), Parietal (P), Occipital (O) y Central (C). Tenga en cuenta que no hay "lóbulo central"; debido a su ubicación, y dependiendo del individuo, los electrodos "C" pueden exhibir / representar la actividad de EEG más típica de la actividad frontal, temporal y algo de parietal-occipital, y siempre se utilizan en estudios de sueño de polisomnografía con el fin de determinar las etapas de dormir.
También hay sitios (Z): Una "Z" (cero) se refiere a un electrodo colocado en el plano sagital de la línea media del cráneo (FpZ, Fz, Cz, Oz) y está presente principalmente para los puntos de referencia / medición. Estos electrodos no necesariamente reflejarán o amplificarán la actividad cortical hemisférica lateral ya que se colocan sobre el cuerpo calloso y no representan adecuadamente ninguno de los hemisferios. "Z" electrodos se utilizan a menudo como 'motivos' o 'referencias', especialmente en los estudios de polisomnografía del sueño y de diagnóstico / clínica montajes EEG supone representa / diagnosticar epileptiforme convulsiónActividad, o posible muerte clínica del cerebro. Tenga en cuenta que el número requerido de electrodos de EEG y su colocación cuidadosa y medida aumentan con cada requisito y modalidad clínica.
Los electrodos de número par (2,4,6,8) se refieren a la colocación de los electrodos en el lado derecho de la cabeza, mientras que los números impares (1,3,5,7) se refieren a los de la izquierda; Esto se aplica tanto a los electrodos de EEG como a los de EOG ( mediciones de electrooculograma de los ojos), así como a la colocación de electrodos de ECG ( mediciones de electrocardiografía del corazón). Los electrodos de barbilla, o EMG ( electromielograma ) son más comúnmente referidos con "derecha", "izquierda" y "referencia" o "común", ya que generalmente solo hay tres colocados, y pueden ser referenciados diferencialmente desde el EEG y sitios de referencia EOG.
La "A" (a veces denominada "M" para el proceso mastoideo) se refiere al proceso óseo prominente que generalmente se encuentra justo detrás del oído externo (menos prominente en niños y algunos adultos). En la polisomnografía básica, se usan F3, F4, Fz, Cz, C3, C4, O1, O2, A1, A2 (M1, M2). Cz y Fz son puntos de referencia 'terrestres' o 'comunes' para todos los electrodos EEG y EOG, y A1-A2 se utilizan para referenciación contralateral de todos los electrodos EEG. Este montaje de EEG puede extenderse para utilizar T3-T4, P3-P4, así como otros, si se requiere un montaje de incautación o extendido.
Medición [ editar ]
Se utilizan puntos de referencia anatómicos específicos para la medición y el posicionamiento esenciales de los electrodos de EEG. Estos se encuentran con una cinta métrica y, a menudo, se marcan con un lápiz de grasa o "marcador de China".
- Nasion a Inion: el nasión es el área claramente deprimida entre los ojos, justo por encima del puente de la nariz, y el inion , es el punto de la parte posterior del cráneo, a menudo indicado por una protuberancia (la prominente cresta occipital cresta, puede generalmente situarse con leve palpación). Las marcas para los electrodos Z se hacen entre estos puntos a lo largo de la línea media, en intervalos de 10%, 20%, 20%, 20%, 20% y 10%.
- Preauricular a preauricular (o tragus a trago: el trago se refiere a la pequeña porción de cartílago que se proyecta anteriormente al pabellón auricular ). El punto preauricural está delante de cada oreja, y se puede ubicar más fácilmente con palpación leve y, si es necesario, solicitar al paciente que abra la boca ligeramente. Los electrodos T3, C3, Cz, C4 y T4 se colocan en marcas hechas a intervalos de 10%, 20%, 20%, 20%, 20% y 10%, respectivamente, medidos en la parte superior de la cabeza.
- La circunferencia del cráneo se mide justo por encima de las orejas (T3 y T4), justo por encima del puente de la nariz (en Fpz), y justo por encima del punto occipital (en Oz). Los electrodos Fp2, f8, T4, T6 y O2 se colocan a intervalos de 10%, 20%, 20%, 20%, 20% y 10%, respectivamente, medidos sobre la oreja derecha, desde la parte delantera (Fpz) hasta la parte posterior (Onz). Lo mismo se hace para los electrodos de número impar en el lado izquierdo, para completar la circunferencia completa.
- Los métodos de medición para la colocación de los puntos F3, F4, P3 y P4 difieren. Si se miden de adelante hacia atrás (montajes Fp1-F3-C3-P3-O1 y Fp2-F4-C4-P4-O2), pueden estar "arriba" un 25% desde los puntos delanteros y traseros (Fp1, Fp2, O1 , y O2). Si se miden de lado a lado (montajes F7-F3-Fz-F4-F8 y T5-P3-Pz-P4-T6), pueden estar un 25% "arriba" de los puntos laterales (F7, F8, T5 y T6). Si se miden en diagonal, desde Nasion hasta Inion hasta los puntos C3 y C4, estarán un 20% por delante y por detrás de los puntos C3 y C4. Cada uno de estos métodos de medición da como resultado diferentes colocaciones nominales de electrodos.
Cuando se colocan los electrodos A (o M), la palpación suele ser necesaria para determinar el punto más pronunciado del proceso mastoideo detrás de cada oreja; si no lo hace, y si coloca los electrodos de referencia demasiado bajos (en la parte posterior a la oreja, proximal a la garganta), se pueden producir "artefactos EKG" en los EEG y los EOG, debido a los artefactos de las arterias carótidas. Se debe tener en cuenta que el artefacto EKG se puede reducir con el filtrado posterior de las señales o mediante el "salto" (co-referenciación) de los electrodos de referencia A / M, si no es posible reemplazar los electrodos de referencia, mejorar o si existen otras consideraciones clínicas. de lo contrario, evitar una buena colocación (como la malformación congénita o consideraciones postquirúrgicas como los implantes cocleares).
Sistemas de alta resolución [ editar ]
Cuando se registra un EEG más detallado con más electrodos, se agregan electrodos adicionales utilizando la división del 10% , que llena los sitios intermedios a medio camino entre los sistemas 10-20 existentes. Este nuevo sistema de nombres de electrodos es más complicado, lo que da lugar a la Nomenclatura Combinatoria Modificada (MCN). Este sistema de MCN utiliza 1, 3, 5, 7, 9 para el hemisferio izquierdo, que representa el 10%, 20%, 30%, 40%, 50% de la distancia de inion a nasion respectivamente. La introducción de códigos de letras adicionales permite nombrar sitios de electrodos intermedios. Tenga en cuenta que estos nuevos códigos de letras no se refieren necesariamente a un área en la corteza cerebral subyacente.
Los nuevos códigos de letras de la MCN para lugares de electrodos intermedios son:
- AF - entre Fp y F
- FC - entre F y C
- FT - entre F y T
- CP - entre C y P
- TP - entre T y P
- PO - entre P y O
Además, el sistema MCN cambia el nombre de cuatro electrodos del sistema 10-20:
- T3 ahora es T7
- T4 ahora es T8
- T5 ahora es P7
- T6 ahora es P8
Se ha sugerido una nomenclatura de mayor resolución que se denomina "sistema al 5%" o "sistema 10–5".
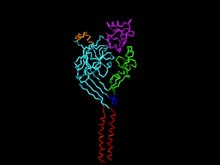
Los canales iónicos de detección de ácido ( ASIC ) son canales de sodio no sensibles al voltaje neuronal activados por protones extracelulares permeables a Na + . ASIC1 también muestra baja permeabilidad al Ca 2+ . [2] Las proteínas ASIC son una subfamilia de la superfamilia de canales iónicos ENaC / Deg . Estos genes tienen variantes de empalme que codifican varias isoformas que están marcadas por un sufijo. En los mamíferos, los canales iónicos de detección de ácido (ASIC) están codificados por cinco genesque producen subunidades de proteína ASIC: ASIC1, ASIC2, ASIC3, ASIC4 y ASIC5 . [3]Tres de estas subunidades de proteínas se ensamblan para formar el ASIC, que puede combinarse en canales homotriméricos y heterotriméricos que se encuentran típicamente en el sistema nervioso central y en el sistema nervioso periférico . [2] Sin embargo, los ASIC más comunes son ASIC1a y ASIC1a / 2a y ASIC3. ASIC2b no es funcional por sí solo pero modula la actividad del canal cuando participa en heteromultímeros y ASIC4 no tiene una función conocida. En gran escala, los ASIC son posibles objetivos farmacológicos debido a su participación en estados patológicos como el daño retiniano, las convulsiones y la lesión cerebral isquémica.
Estructura [ editar ]
Cada canal iónico sensible al ácido está compuesto por una secuencia de aminoácidos de 500 a 560, que se construye en un segmento de seis transmembranas: dos por subunidad (TMD1 y TMD2), un terminal amino-carboxilo citoplásmico y un gran dominio extracelular. [3] Los dominios de los extremos amino-carboxilo intracelulares son vitales para las interacciones y modulaciones de las proteínas intracelulares del canal, la permeabilidad de los iones y la activación. Sin embargo, la puerta y la mecánica de cada canal iónico sensible al ácido está determinada por la combinación de subunidades ASIC que forman su estructura. [3]
Poro [ editar ]
La mecánica de la función de poro es fundamental para la estructura del canal. Entre las tres subunidades ASIC1, un túnel se extiende desde la parte superior de los dominios extracelulares hasta el citoplasma de la célula. El túnel central corre directamente entre la unidad trimérica, donde tiene grandes áreas restringidas que cambian de tamaño y forma según el estado del canal. [3]
Los dos dominios transmembrana (TMD1 y TMD2) de cada una de las tres subunidades ASIC son responsables de los poros del canal. TMD2 está involucrado principalmente con el revestimiento de la luz dentro del poro y la puerta de inactivación del canal, donde TMD1 contiene la proteína dentro de la bicapa lipídica de la célula . [6]TMD1 está conectado a las hojas β del dominio extracelular que se flexionan para ampliar el dominio extracelular para permitir el paso de iones a través del canal. [3] Entre los segmentos de TMD2 se encuentra un filtro de selectividad que forma la parte más estrecha del poro, que es responsable de la permisibilidad de ASIC a la mayoría de Na + . Para ASIC1, nueve residuos de aminoácidos, tres aportados por cada subunidad ASIC (Gly443, Ala444, Ser445), forman el filtro de selectividad. Apodado el "cinturón de GAS", los tres carboniloxígenos alinean el poro, produciendo un potencial negativo que contribuye a la conductancia de los cationes. [3] El residuo de aminoácido específico del aspartato en la luz lateral extracelular de TMD2 en ASIC1 se ha relacionado con la baja conductancia de Ca 2+ del canal . Además, los residuos n-terminales de la región transmembrana también han mostrado selectividad por Na + , ya que las mutaciones dentro de esta región tienen una función alterada y la conductancia de Na + . [3]
Región extracelular [ editar ]
Los ASIC tienen una gran región extracelular tipo puño que consume la mayor parte de la estructura de las proteínas. Dentro de su estructura de "puño" hay dominios de muñeca, palma, dedo, nudillo, pulgar y bola β. La "palma" constituye la mayor parte del dominio extracelular, formado por siete hojas β, donde el resto de los dominios estructurales secundarios se componen de segmentos α-helicoidales. [3] Distinguida por sus configuraciones específicas de aminoácidos, la región extracelular es fundamental para la inducción de la activación / inactivación junto con la activación del pH . El área específica del bucle de hoja β entre los dominios "palma" y "pulgar" ha mostrado participación en la transducción de señales desde el dominio extracelular a las regiones transmembrana.[3] Sin embargo, sigue siendo bastante poco concluyente sobre qué residuos particulares interactúan con los protones para activar el canal. En 2009, los estudios pueden haber establecido una relación entre los residuos aromáticos Tyr72, Pro287 y Trp288 y la activación de protones del ASIC. [3] Estos residuos forman una bolsa ácida que expresa potenciales electrostáticos que son responsables de la dependencia del pH en la activación y modulación del canal. [7] Este bolsillo en el dominio extracelular actúa como una reserva para que los cationes se concentren para ayudar aún más en la entrada de Na + . GlicosilaciónTambién es evidente dentro de la región extracelular, desempeñando un papel importante en el tráfico del canal a la superficie de la membrana, así como al establecer la sensibilidad del ASIC a los niveles de pH. Pruebas experimentales adicionales han indicado que el Ca 2+ también puede desempeñar un papel fundamental en la modulación de la afinidad de protones de ASIC tanto dentro del poro como en el dominio extracelular. [3]
Función [ editar ]
La función del ASIC es detectar niveles reducidos de pH extracelular y dar como resultado una respuesta o señal de la neurona. Durante mucho tiempo se pensó que el ligando que se une al sitio de activación era exclusivamente protones; sin embargo, estudios recientes han demostrado que ASIC4 y ASIC1 pueden activarse a niveles de pH normales, lo que indica otros tipos de ligantes ligantes. [8]Bajo condiciones acídicas aumentadas, un protón se une al canal en la región extracelular, activando el canal iónico para pasar por un cambio conformacional, abriendo así el dominio transmembrana 2 (TMD2). Esto resulta en la entrada de iones de sodio a través de la luz de TMD2. Todos los ASIC son específicamente permeables a los iones de sodio. La única variante es ASIC1a, que también tiene una baja permeabilidad a los iones de calcio. La afluencia de estos cationes da como resultado la despolarización de la membrana. Los canales de Ca 2+ dependientes de voltaje se activan, lo que resulta en una entrada de calcio en la célula. Esto causa la despolarización de la neurona y se libera una respuesta excitadora. En ASIC1a, el aumento de Ca 2+ dentro de la célula es el resultado de la entrada de calcio directamente a través del canal.[8]
Una vez activado, el ASIC puede desencadenar multitud de diferentes proteínas efectoras y moléculas de señalización para provocar diferentes reacciones de la célula. Es decir, la α-actinina da como resultado una mayor sensibilidad al pH y recuperación de la desensibilización. También pueden aumentar la densidad del flujo de corriente a través del canal. [8] También hay muchas proteínas quinasas que regulan la función ASIC a través de la fosforilación . Estos incluyen la proteína quinasa A (PKA) y la proteína quinasa C (PKC). Se cree que hay muchos más reguladores, sin embargo, sus efectos no se han concluido experimentalmente. [8]
Hay algunos otros factores que pueden desempeñar un papel en la regulación de los ASIC. Se dice que la presencia de glicanos ligados a N madurados en la superficie del canal permite que el canal realice un tráfico preferencial para ASIC1a. Este es un resultado del aumento de los sitios de N-glicosilación en ASIC1a y ASIC2a. [8] Los altos niveles de glicerol (conocidos por acelerar la maduración de proteínas) en la superficie de ASIC2 también ayudan en la implicación de que la regulación de la función de estos canales depende de la maduración de proteínas. También se plantea la hipótesis de que la oxidación desempeña un papel en el tráfico. [8]
Ubicación [ editar ]
La mayoría de los ASIC se expresan en el sistema nervioso. ASIC1, ASIC2, ASIC2b y ASIC4 se expresan comúnmente tanto en el sistema nervioso central como en el periférico, mientras que ASIC1b y ASIC3 generalmente solo se ubican en el periférico.
En el sistema nervioso periférico, los ASIC se encuentran dentro de los cuerpos celulares de las membranas postsinápticas y las terminales nerviosas sensoriales. Además, los ASIC se encuentran típicamente en las fibras nerviosas aferentes de la piel, los músculos, las articulaciones y las vísceras, donde se ha descubierto que están asociados con el dolor, el gusto y las funciones gastrointestinales. [6]
En el sistema nervioso central, los ASIC se encuentran generalmente en el cuerno dorsal de la médula espinal . [4] ASIC1 se concentra específicamente en la amígdala , lo que ilustra su papel en el comportamiento ansioso y se ha encontrado ASIC3 en el órgano de Corti y el ganglio espiral que ilustra el papel de este canal específico en la percepción auditiva y visual. [6]
Fisiología [ editar ]
Los ASIC son objetivos potenciales de medicamentos para tratar una amplia variedad de afecciones relacionadas tanto con el SNC como con el SNP. [4] [5] De particular interés para el campo del dolor es el subtipo de receptor ASIC3, que se expresa específicamente en los nociceptores . Este subtipo exhibe una corriente bifásica en la activación de protones, donde la corriente inicial de Na + hacia adentro es seguida brevemente por una corriente catiónica sostenida.
Los ASIC son importantes en la función de la retina y ofrecen protección en respuesta a la luz brillante. La susceptibilidad del daño retiniano aumenta después de la eliminación del gen ASIC2. Se produjo un aumento de la apoptosis en respuesta a la luz brillante en un gen ASIC2 - / - en comparación con la retina de tipo salvaje. [8]
Los canales ASIC1a también desempeñan un papel en la protección contra la actividad de incautación. Las convulsiones causan un aumento de la actividad neuronal no controlada en el cerebro que libera grandes cantidades de vesículas ácidas. [5] Los canales ASIC1a se abren en respuesta y han demostrado proteger contra las convulsiones al reducir su progresión. Los estudios que investigan este fenómeno han encontrado que la eliminación del gen ASIC1a resultó en una actividad de ataques amplificada. [8]
Los canales ASIC1a se abren específicamente en respuesta al pH 5.0-6.9 y contribuyen a la patología de la lesión cerebral isquémica porque su activación causa un pequeño aumento en la permeabilidad del Ca 2+ y un flujo interno de Ca 2+ . Los canales ASIC1a además facilitan la activación de los canales de Ca2 + dependientes de voltaje y los canales receptores de NMDA en la despolarización inicial, lo que contribuye al mayor aumento de calcio intracelular que resulta en la muerte celular. [9] Un posible mecanismo de muerte celular mediada por un canal ASIC1a se debe a la activación de otros canales, lo que lleva a un Ca 2+ elevado que crea vías de señalización para la apoptosis y la necrosis en la célula. [5]Los estudios genéticos y los bloqueos de ASIC han demostrado reducir el volumen del infarto cerebral hasta en un 60%, lo que sugiere que los canales de ASIC desempeñan un papel importante en el desarrollo de los estados patológicos resultantes de la acidosis y la lesión neuronal inducida por isquemia . [9] Los efectos de los bloqueos ASIC y NMDA se han estudiado para determinar los roles de ambos canales en la toxicidad de Ca 2+ y evaluar sus respectivas contribuciones. El uso del bloqueo para ambos canales proporciona una mayor neuroprotección que el uso de un bloqueo para un solo canal, y el bloqueo ASIC crea una eficacia prolongada del bloqueo NMDA. [9]
Farmacología [ editar ]
Debido al papel de los canales iónicos de detección de ácido en la percepción del dolor y varios procesos fisiopatológicos, tienen un significado farmacológico como diana farmacológica para la inhibición. Los canales iónicos sensibles al ácido se encuentran tanto en las neuronas centrales como en las periféricas. La modulación de la actividad ASIC también puede controlar los síntomas adversos de comportamiento y emocionales del dolor crónico, como la ansiedad y la depresión.
Se observa que los canales iónicos de detección de ácido (ASIC) se activan a pH inferiores a ~ 6 con variabilidad según el tipo de canal y su ubicación. Una disminución en el pH puede deberse a una variedad de razones que incluyen inflamación del tejido, accidente cerebrovascular isquémico y una acumulación de ácido láctico debido al aumento del metabolismo celular. La activación del canal provoca un aumento de la permeabilidad de los iones de sodio que despolariza la célula e induce la activación de un potencial de acción . Los potenciales de acción resultantes se pueden modular a través de inhibidores de moléculas pequeñas.
La amilorida es un ejemplo de un inhibidor de ASIC, aunque no se considera altamente potente debido a un valor de CI50 en el rango micromolar, ha permitido realizar estudios sobre los efectos de la inhibición de ASIC en migrañas. Durante una migraña , se observa una depresión de la extensión cortical que provoca desequilibrios iónicos y la liberación de moléculas cargadas que pueden activar el ASIC. Las pruebas de amilorida en roedores, mostraron una disminución en la depresión de la extensión cortical durante una migraña. Los estudios demostraron que la amilorida actúa como un inhibidor competitivo.de los capítulos de la ASIC. El uso de amilorida también mostró efectos secundarios en roedores debido a la inhibición de los intercambiadores de sodio / calcio. La inhibición de estos intercambiadores altera la homeostasis del calcio celular y causa altos niveles de calcio en la célula, lo que explica la reducción de la eficacia neuroprotectora con el uso de amilorida. Los hallazgos que han surgido debido a la inhibición de ASIC por amilorida son prometedores y respaldan el potencial terapéutico. Sin embargo, debido a la falta de especificidad y potencia de la amilorida, será necesario realizar un mayor desarrollo del fármaco en su estructura antes de que se pueda liberar un fármaco. [10] [9]
Un inhibidor de molécula pequeña, A-317567, muestra más potencial terapéutico que la amilorida con una mayor especificidad a los canales ASIC y una mayor potencia. Aunque A-317567 muestra poca selectividad para los diferentes tipos de canales ASIC, los hallazgos in vivo mostraron que los efectos secundarios observados con el uso de amilorida se evitan debido a la especificidad de A-317567 para ASIC. Además, el A-317567 tiene la capacidad de mantener la inhibición de corrientes sostenidas que podrían ser prometedoras específicamente en condiciones crónicas mediadas por acidosis. [9]
El inhibidor más eficaz y más conocido de los ASIC es PcTX1. PcTX1 inhibe específicamente el ASICa y tiene un valor de IC50 en el rango nanomolar, un IC50 más pequeño que todos los demás inhibidores de ASIC conocidos que han estado en el rango micromolar. Además, PcTX1 no inhibe otros canales iónicos dependientes de voltajeo canales activados por ligando . La estructura de este inhibidor es de 40 aminoácidos unidos con enlaces disulfuro . Se identificó como una toxina peptídica de la tarántula sudamericana Psalmopoeus Cambridge . [9]Cuando se administró PcTX1 dentro de la amígdala basolateral de ratas, los síntomas relacionados con la emoción y la ansiedad asociados con el dolor disminuyeron significativamente. [11]
Se ha encontrado que los fármacos antiinflamatorios no esteroides ( AINE ) de uso común desempeñan un papel en la inhibición de ASIC que contribuye a la modulación del dolor. El mecanismo bien conocido para la función de los AINE es su inhibición de la síntesis de prostaglandinas, un importante compuesto inflamatorio. Sin embargo, los hallazgos muestran que los AINE ibuprofeno y la aspirina inhiben los ASIC con valores de CI50 de 350 µM y 260 µM, respectivamente. Es probable que los AINE inhiban la corriente ASIC durante el dolor agudo, en particular el causado por la inflamación del tejido, y por lo tanto inhiben la señal a las neuronas sensibles al dolor. [9]
Al promover la investigación sobre el potencial farmacológico en la inhibición de ASIC, los pacientes que sufren dolor crónico y diversas patologías asociadas con la acidosis pueden tener mayores opciones de tratamiento en el futuro. Además, los estudios de descubrimiento de fármacos de ASIC proporcionan un mayor conocimiento sobre la función de los propios canales y su importancia fisiológica.
No hay comentarios:
Publicar un comentario