El carbono diatómico (sistemáticamente denominado dicarbonato y 1λ 2 , 2λ 2- eteno , es un químico inorgánicogaseoso verde con la fórmula química C = C (también escrito [C
2 ]oC
2 ). Es cinéticamente inestable a temperatura y presión ambiente, y se elimina mediante autopolimerización. Ocurre en vapor de carbono, por ejemplo enarcos eléctricos; encometas,atmósferas estelaresy elmedio interestelar; y enllamas dehidrocarburos azules. [1] El carbono diatómico es la segunda forma más simple de carbono después del carbonoatómico, y es un participante intermedio en la génesis de los fullerenos.
Propiedades [ editar ]
C 2 es un componente del vapor de carbono. Un artículo estima que el vapor de carbono es alrededor del 28% diatómico, [2] pero en teoría esto depende de la temperatura y la presión.
Propiedades electromagnéticas [ editar ]
Los electrones en el carbono diatómico se distribuyen entre los orbitales atómicos de acuerdo con el principio aufbau para producir estados cuánticos únicos, con los niveles de energía correspondientes. El estado con el nivel de energía más bajo, o estado fundamental, es un estado de singlete ( 1 Σ +
g ), que se denomina sistemáticamente eteno-1,2-diilideno o dicarbonado (0 •). Hay varios estados excitados de singlete y triplete que son relativamente cercanos en energía al estado fundamental, que forman proporciones significativas de una muestra de dicarbon en condiciones ambientales. Cuando la mayoría de estos estados excitados experimentan relajación fotoquímica, se emiten en la región infrarroja del espectro electromagnético. Sin embargo, un estado en particular emite en la región verde. Ese estado es un estado triplete ( 3 Πg ), que se denomina sistemáticamente eteno-μ, μ-diil-μ-ilideno o dicarbon (2 •). Además, hay un estado excitado algo más en la energía del estado fundamental, que solo forma una proporción significativa de una muestra de dicarbonado bajo la irradiación de ultravioleta medio. Al relajarse, este estado excitado emite fluorescencia en la región violeta y fosforescencia en la región azul. Este estado también es un estado singlete ( 1 Π g ), que también se denomina eteno-μ, μ-diil-μ-ilideno o dicarbon (2 •).
g ), que se denomina sistemáticamente eteno-1,2-diilideno o dicarbonado (0 •). Hay varios estados excitados de singlete y triplete que son relativamente cercanos en energía al estado fundamental, que forman proporciones significativas de una muestra de dicarbon en condiciones ambientales. Cuando la mayoría de estos estados excitados experimentan relajación fotoquímica, se emiten en la región infrarroja del espectro electromagnético. Sin embargo, un estado en particular emite en la región verde. Ese estado es un estado triplete ( 3 Πg ), que se denomina sistemáticamente eteno-μ, μ-diil-μ-ilideno o dicarbon (2 •). Además, hay un estado excitado algo más en la energía del estado fundamental, que solo forma una proporción significativa de una muestra de dicarbonado bajo la irradiación de ultravioleta medio. Al relajarse, este estado excitado emite fluorescencia en la región violeta y fosforescencia en la región azul. Este estado también es un estado singlete ( 1 Π g ), que también se denomina eteno-μ, μ-diil-μ-ilideno o dicarbon (2 •).
| Estado | Excitación entalpía (kJ mol -1) | Transición derelajación | Longitud de onda derelajación | Relajación EM-región |
|---|---|---|---|---|
| X 1 Σ + g | 0 | - | - | - |
| un 3 Π tu | 8.5 | un 3 Π u →X1Σ+ g | 14.0 μm | Infrarrojo de longitud de onda larga |
| b 3 Σ - g | 77.0 | b 3 Σ - g → a 3 Π tu | 1.7 μm | Infrarrojo de onda corta |
| A 1 Π tu | 100.4 | A 1 Π u →X1Σ+ g A1Π u →b3Σ- g | 1.2 μm 5.1 μm | Infrarrojo cercano infrarrojo de longitud de onda media |
| B 1 Σ + g | ? | B 1 Σ + g → A 1 Π u B1Σ+ g →a3Π tu | ? ? | ? ? |
| c 3 Σ + u | 159.3 | c 3 Σ + u → b 3 Σ - g c 3 Σ + u → X 1 Σ + g c 3 Σ + u → B 1 Σ + g | 1.5 μm 751.0 nm ? | Infrarrojo de onda corta ¿Infrarrojo cercano ? |
| d 3 Π sol | 239.5 | d 3 Π g →a3Π tu d3Π g →c3Σ+ u d3Π g →A1Π tu | 518.0 nm 1.5 μm 860.0 nm | Verde infrarrojo de longitud de onda corta infrarrojo cercano |
| C 1 Π sol | 409.9 | C 1 Π g →A1Π u C1Π g →a3Π u C1Π g →c3Σ+ u | 386,6 nm 298,0 nm 477,4 nm | Azul violeta medio ultravioleta |
La teoría orbital molecular muestra que hay dos conjuntos de electrones pareados en un conjunto degenerado de enlaces orbitales pi. Esto da un orden de enlace de 2, lo que significa que debe existir un enlace doble entre los dos carbonos en una molécula de C 2 . [3] Un análisis sugiere, en cambio, que existe un enlace cuádruple , [4] una interpretación que se cuestionó. [5]
Los cálculos de CASSCF indican que el enlace cuádruple basado en la teoría de los orbitales moleculares también es razonable. [3]
Las energías de disociación de enlace de B 2 , C 2 y N 2 muestran un aumento de BDE, lo que indica enlaces simples, dobles y triples, respectivamente.
En ciertas formas de carbono cristalino, como el diamante y el grafito, un punto de silla de montar o "joroba" se produce en el sitio de enlace en la densidad de carga. El estado triplete de C 2 sigue esta tendencia. Sin embargo, el estado de singlete de C 2 actúa más como silicio o germanio; es decir, la densidad de carga tiene un máximo en el sitio de enlace. [6]
Reacciones [ editar ]
El carbono diatómico reaccionará con la acetona y el acetaldehído para producir acetileno por dos vías diferentes. [2]
- Las moléculas de triplete C 2 reaccionarán a través de una vía intermolecular, que se muestra que exhibe un carácter radical. El intermedio para esta vía es el radical etileno. Su abstracción se correlaciona con las energías de enlace. [2]
- Las moléculas singletes de C 2 reaccionarán a través de una vía intramolecular, no radical, en la que dos átomos de hidrógeno se eliminarán de una molécula. El intermedio para esta vía es el vinilideno singlete . La reacción singlete puede ocurrir a través de una distracción 1,1-diab o una distracción 1,2-diab. Esta reacción es insensible a la sustitución de isótopos. Las diferentes abstracciones se deben posiblemente a las orientaciones espaciales de las colisiones en lugar de a las energías de enlace. [2]
- Singlet C 2 también reaccionará con alquenos . El acetileno es un producto importante; sin embargo, parece que el C 2 se insertará en los enlaces carbono-hidrógeno.
- C 2 es 2.5 veces más probable que se inserte en un grupo metilo que en grupos metileno . [7]
Historia [ editar ]
La luz de los cometas más débiles se origina principalmente en la emisión de carbono diatómico. Un ejemplo es C / 2014 Q2 (Lovejoy) , donde hay varias líneas de luz C 2 , principalmente en el espectro visible, que forman las bandas de Swan .
| Los nombres | |
|---|---|
| Nombre IUPAC
Carbono diatomico
| |
| Nombre de IUPAC sistemático
Etenediilideno (sustitutivo)
Dicarbon ( C - C ) (aditivo) | |
| Identificadores | |
| CHEBI | |
| ChemSpider | |
| 196 | |
PubChem CID
| |
| Propiedades | |
| C 2 | |
| Masa molar | 24.022 g · mol −1 |
Excepto donde se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa).
| |
 | |
 | |
| Los nombres | |
|---|---|
| Nombre IUPAC | |
| Identificadores | |
| ChemSpider | |
PubChem CID
| |
| Propiedades | |
| Li 2 | |
| Masa molar | 13.88 g · mol −1 |
Excepto donde se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa).
| |
| Referencias de infobox | |
Dilithium , Li 2 , es un fuertemente electrófilo , diatómico molécula que comprende dos litio átomos unidos covalentemente juntos. Li 2es conocido en la fase gaseosa . Tiene un orden de enlace de 1, una separación internuclear de 267.3 pm y una energía de enlacede 102 kJ mol −1 o 1.06eV en cada enlace. [1] La configuración electrónica de Li 2 puede escribirse como σ 2 .
Se ha observado que el 1% (en masa) de litio en la fase de vapor se encuentra en forma de dilitio. [ cita requerida ] [ aclaración necesaria ]
Siendo la molécula diatómica homonuclear neutra más liviana y estable después del H 2 , y el dímero de helio , el dilitio es un sistema modelo extremadamente importante para el estudio de los fundamentos de la física, la química y la teoría de la estructura electrónica . Es el compuesto mejor caracterizado en términos de la precisión y la integridad de las curvas de energía potencial empírica de sus estados electrónicos. Se han construido curvas analíticas de energía potencial empírica para el estado X, [2] estado a, [3] estado A, [4] estado c, [5] estado B, [6] estado 2d, [ 7] estado-l, [7] estado-E,[8] y el estado F [9] principalmente por los profesores Robert J. Le Roy [2] [3] [6] de la Universidad de Waterloo y Nike Dattani [2] [3] [4] [5]de la Universidad de Oxford . Las más confiables de estas curvas de energía potencial son de lavariedad Morse / Long-range .
Los potenciales de Li 2 se usan a menudo para extraer propiedades atómicas. Por ejemplo, el valor de C 3 para el litio atómico extraído del potencial del estado A de Li 2 por Le Roy et al. en [2] es más preciso que cualquier fuerza del oscilador atómico medida previamente. [10] Esta fuerza del oscilador de litio está relacionada con la vida útil de la radiación del litio atómico y se utiliza como punto de referencia para los relojes atómicos y las mediciones de constantes fundamentales.
| Estado electronico | Simbolo espectroscopico | Símbolo de término molecular | Longitud de la fianza en pm | Energía de disociación en cm −1 | # de niveles vibracionales ligados | Referencias |
|---|---|---|---|---|---|---|
| Suelo | X | 1 1 Σ g + | 267.298 74 (19) [2] | 8 516.780 0 (23) [2] | 39 [2] | [2] |
| 2 | una | 1 3 Σ u + | 417.000 6 (32) [3] | 333.779 5 (62)[3] | 11 [3] | [3] |
| 3 | segundo | 1 3 Π u | [7] | |||
| 4 | UNA | 1 1 Σ g + | 310.792 88 (36) [2] | 9 353.179 5 (28) [2] | 118 [2] | [2] |
| 5 | do | 1 3 Σ g + | 306.543 6 (16) [3] | 7093.4926 (86) [3] | 104 [3] | |
| 6 | segundo | 1 1 Π u | 293.617 142 (310)[6] | 298 4.444 [6] | 118 [6] | |
| 7 | mi | 3 (?) 1 Σ g + | [8] |
| Los nombres | |||
|---|---|---|---|
| Nombre IUPAC
Difosforo
| |||
| Nombre de IUPAC sistemático
Difosfina [1]
| |||
| Identificadores | |||
| CHEBI | |||
| ChemSpider | |||
| 1400241 | |||
PubChem CID
| |||
| Propiedades | |||
| P 2 | |||
| Masa molar | 61.947 523 996 g · mol −1 | ||
Excepto donde se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 ° C [77 ° F], 100 kPa).
| |||
| Referencias de infobox | |||
El difósforo es un químico inorgánico con la fórmula química P
2 . A diferencia de sugrupovecino denitrógeno, elnitrógeno, que forma unamolécula deN2establecon untriple enlacenitrógeno a nitrógeno, el fósforo prefiere una forma P4tetraédricaporquelos enlaces pi pison altos en energía. El difósforo es, por lo tanto, muy reactivo con unaenergía de disociación de enlace(117kcal/molo 490kJ/ mol) la mitad deldinitrógeno. La distancia de enlace se ha medido en 1.8934 Å. [2]
2 . A diferencia de sugrupovecino denitrógeno, elnitrógeno, que forma unamolécula deN2establecon untriple enlacenitrógeno a nitrógeno, el fósforo prefiere una forma P4tetraédricaporquelos enlaces pi pison altos en energía. El difósforo es, por lo tanto, muy reactivo con unaenergía de disociación de enlace(117kcal/molo 490kJ/ mol) la mitad deldinitrógeno. La distancia de enlace se ha medido en 1.8934 Å. [2]
Se ha generado difósforo calentando fósforo blanco a 1100 kelvins(827 ° C ). Sin embargo, se han obtenido algunos avances en la generación de la molécula diatómica en solución homogénea en condiciones normales con el uso de algunos complejos de metales de transición (basados, por ejemplo, en tungsteno y niobio ). [3]También se propusieron métodos para la disociación de enlaces en moléculas de P 4 a través de la fotoexcitación . [4]
La molécula llamó la atención en 2006, cuando surgió un nuevo método para su síntesis a temperaturas más suaves. [3]
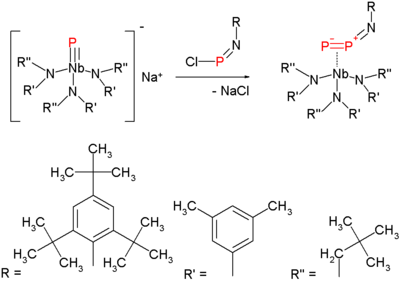
Este método es una variación de la expulsión de nitrógeno en azidas con formación de un nitreno . La síntesis del precursor difósforo consiste en hacer reaccionar un fosfuro de niobio terminal con un cloroiminofosfano:
Calentar este compuesto a 50 ° C en 1,3-ciclohexadieno que sirve como solvente y como reactivo de atrapamiento expulsa el difósforo, que es reactivo, ya que forma un aducto doble de Diels-Alder y el compuesto de imio de niobio:
El mismo compuesto imido también se forma cuando la termólisis se realiza en tolueno, pero luego se desconoce el destino del difósforo.
Se ha sugerido que el P 2 se forma como un intermediario en la fotolisis del P 4 [5] y en presencia de 2,3-dimetil-1,3-butadieno se forma nuevamente el difosfano. [6] Hasta la fecha, no existe evidencia directa de la formación de P 2 a través de la fotólisis de P 4 .
Se ha reportado la generación de difósforo a partir de un aducto de bisantraceno difósforo. [7] La síntesis de un HP estabilizado 2 + catión ha informado




No hay comentarios:
Publicar un comentario