La doble resonancia nuclear electrónica (ENDOR) es una técnica de resonancia magnética para dilucidar la estructura molecular y electrónica de las especies paramagnéticas. [1] La técnica se introdujo por primera vez para resolver las interacciones en los espectros de resonancia paramagnética electrónica (EPR). [2] [3]Actualmente se practica en una variedad de modalidades, principalmente en las áreas de biofísica y catálisis heterogénea .
Experimento CW [ editar ]
En el experimento de onda continua estándar (cwENDOR), una muestra se coloca en un campo magnético y se irradia secuencialmente con un microondas seguido de radiofrecuencia . Los cambios se detectan luego monitoreando las variaciones en la polarización de la transición de resonancia paramagnética de electronessaturados (EPR). [4]
Teoría [ editar ]
ENDOR se ilustra mediante un sistema de dos espines que involucra un electrón (S = 1/2) y un protón (I = 1/2) que interactúan con un campo magnético aplicado.
El hamiltoniano para el sistema [ editar ]
El Hamiltoniano para el sistema de doble giro mencionado anteriormente se puede describir como
Los cuatro términos en esta ecuación describen la interacción de Zeeman de electrones (EZ), la interacción de Zeeman nuclear (NZ), la interacción de hiperfina (HFS) y la interacción del cuadrupolo nuclear (Q), respectivamente. [4]
La interacción electrónica de Zeeman describe la interacción entre un giro de electrones y el campo magnético aplicado. La interacción nuclear de Zeeman es la interacción del momento magnético del protón con un campo magnético aplicado. La interacción hiperfina es el acoplamiento entre el espín del electrón y el espín nuclear del protón. La interacción cuadrupolo nuclear está presente solo en los núcleos con I> 1/2.
Los espectros de ENDOR contienen información sobre el tipo de núcleos en la vecindad del electrón no pareado (NZ y EZ), sobre las distancias entre los núcleos y sobre la distribución de densidad de espín (HFS) y sobre el gradiente del campo eléctrico en los núcleos (Q).
Principio del método ENDOR [ editar ]
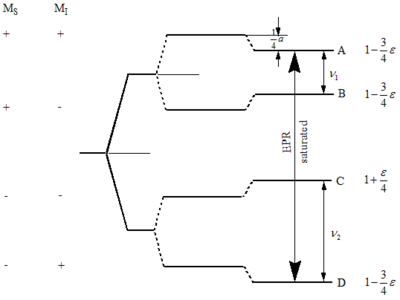
La figura de la derecha ilustra el diagrama de energía del sistema de espín más simple, donde a es la constante de acoplamiento hiperfina isotrópica en hercios (Hz). Este diagrama indica el electrón Zeeman, el nuclear Zeeman y las divisiones hiperfinas. En un experimento ENDOR de estado estacionario, una transición EPR (A, D), llamada observador, está parcialmente saturada por la radiación de microondas de amplitud mientras que un campo de amplitud de radio frecuencia de conducción (rf) , llamada la bomba, induce transiciones nucleares. [5] Las transiciones ocurren en las frecuencias y y obedecer las reglas de selección de RMN. y . Estas transiciones de RMN son detectadas por ENDOR a través de los cambios de intensidad a la transición de EPR irradiada simultáneamente. Es importante darse cuenta de que tanto la constante de acoplamiento hiperfina (a) como las frecuencias de Larmor nuclear () se determinan cuando se utiliza el método ENDOR. [6]
Requisito para ENDOR [ editar ]
Un requisito para ENDOR es la saturación parcial de las transiciones EPR y RMN definidas por
y
dónde y son la relación gyromagnetic del electrón y el núcleo respectivamente. es el campo magnético del observador que es la radiación de microondas mientras Es el campo magnético de la bomba que es la radiación de radiofrecuencia. y son el tiempo de relajación de la red de espín para el electrón y el núcleo respectivamente. y son el tiempo de relajación de espín y espín para el electrón y el núcleo respectivamente.
Espectroscopia ENDOR [ editar ]
EI-EPR [ editar ]
El EPR inducido por ENDOR (EI-EPR) muestra las transiciones de ENDOR en función del campo magnético. Mientras el campo magnético es barrido a través del espectro EPR, la frecuencia sigue la frecuencia de Zeeman del núcleo. Los espectros EI-EPR se pueden recopilar de dos maneras: (1) espectros de diferencia [7] (2) campo de rf modulado en frecuencia sin la modulación de Zeeman.
Esta técnica fue establecida por Hyde [7] y es especialmente útil para separar señales EPR superpuestas que resultan de diferentes radicales, conformaciones moleculares o sitios magnéticos. Los cambios del monitor de espectros EI-EPR en la amplitud de una línea ENDOR de la muestra paramagnética, se muestran como una función del campo magnético. Debido a esto, los espectros corresponden a una sola especie. [5]
Doble ENDOR [ editar ]
La resonancia doble electrón-nuclear-doble (ENDOR doble) requiere la aplicación de dos campos rf (RF1 y RF2) a la muestra. El cambio en la intensidad de la señal de RF1 se observa mientras RF2 es barrido a través del espectro. [5] Los dos campos están orientados perpendicularmente y son controlados por dos circuitos de resonancia sintonizables que se pueden ajustar de manera independiente uno del otro. [8] En los experimentos de desacoplamiento de espín, [9] la amplitud del campo de desacoplamiento debe ser lo más grande posible. Sin embargo, en múltiples estudios de transición cuántica, ambos campos rf deben ser maximizados.
Esta técnica fue introducida por primera vez por Cook y Whiffen [10] y se diseñó de modo que se pudieran determinar los signos relativos de las constantes de acoplamiento de hf en los cristales, así como la separación de las señales superpuestas.
CP-ENDOR y PM-ENDOR [ editar ]
La técnica CP-ENDOR utiliza campos de rf polarizados circularmente. Dos campos de polarización lineal son generados por corrientes de RF en dos cables que están orientados en paralelo al campo magnético. Luego, los cables se conectan en medio bucles que luego se cruzan en un ángulo de 90 grados. Esta técnica fue desarrollada por Schweiger y Gunthard para poder simplificar la densidad de las líneas de ENDOR en un espectro paramagnético. [11]
La polarización modulada ENDOR (PM-ENDOR) utiliza dos campos de rf perpendiculares con unidades de control de fase similares a las de CP-ENDOR. Sin embargo, se utiliza un campo de rf polarizado linealmente que gira en el plano xy a una frecuencia menor que la frecuencia de modulación de la portadora de rf. [5]
Aplicaciones [ editar ]
En medios policristalinos o soluciones congeladas, ENDOR puede proporcionar relaciones espaciales entre los núcleos acoplados y los espines electrónicos. Esto es posible en fases sólidas donde el espectro EPR surge de la observancia de todas las orientaciones de las especies paramagnéticas; como tal, el espectro EPR está dominado por grandes interacciones anisotrópicas. Esto no es así en muestras de fase líquida donde las relaciones espaciales no son posibles. Tales disposiciones espaciales requieren que los espectros de ENDOR se registren en diferentes configuraciones de campo magnético dentro del patrón de polvo EPR. [12]
La convención tradicional de resonancia magnética prevé que los parámetros se alinean con el campo magnético externo; sin embargo, en la práctica es más sencillo tratar los parámetros como fijos y el campo magnético externo como un vector. La especificación de relaciones posicionales requiere tres piezas de información separadas pero relacionadas: un origen, la distancia desde dicho origen y una dirección de esa distancia. [13] El origen, a los efectos de esta explicación, puede considerarse como la posición de una molécula localizada de electrones no pareados. Para determinar la dirección al núcleo de espín activo desde el electrón no pareado localizado (recuerde: los electrones no emparejados son, ellos mismos, el espín activo), se emplea el principio de selección del ángulo magnético. El valor exacto de θ se calcula de la siguiente manera a la derecha:
En θ = 0˚, los espectros de ENDOR contienen solo el componente de acoplamiento hiperfino que es paralelo a los protones axiales y perpendicular a los protones ecuatoriales. En θ = 90˚, los espectros ENDOR contienen solo el componente de acoplamiento hiperfino que es perpendicular a los protones axiales y paralelo a los protones ecuatoriales. La distancia nuclear electrónica (R), en metros, a lo largo de la dirección de la interacción se determina por aproximación punto-dipolo. Dicha aproximación toma en cuenta las interacciones magnéticas a través del espacio de los dos dipolos magnéticos. El aislamiento de R proporciona la distancia desde el origen (electrón no apareado localizado) hasta el núcleo activo de espín. Las aproximaciones punto-dipolo se calculan usando la siguiente ecuación de la derecha:
La técnica ENDOR se ha utilizado para caracterizar la estructura espacial y electrónica de los sitios que contienen metales. iones / complejos de metales paramagnéticos introducidos para catálisis; racimos metálicos que producen materiales magnéticos; Radicales atrapados introducidos como sondas para revelar las propiedades de ácido / base de superficie; centros de color y defectos como en el azul ultramar y otras gemas; y compuestos de reacción atrapados catalíticamente que detallan el mecanismo. La aplicación de ENDOR pulsado a muestras sólidas ofrece muchas ventajas en comparación con CW ENDOR. Tales ventajas son la generación de formas de línea sin distorsión, la manipulación de los espines a través de una variedad de secuencias de pulsos y la falta de dependencia de un equilibrio sensible entre las tasas de relajación de los espines del electrón y el nuclear y la potencia aplicada (dados los índices de relajación lo suficientemente largos).[12]
HF pulsado ENDOR se aplica generalmente a sistemas de modelos biológicos y relacionados. Las aplicaciones se han centrado principalmente en la biología con un gran énfasis en radicales relacionados con la fotosíntesis o en centros de iones metálicos paramagnéticos en mataloenzimas o metaloproteínas. [14]Aplicaciones adicionales han sido agentes de contraste de imagen de resonancia magnética. HF ENDOR se ha utilizado como una herramienta de caracterización para materiales porosos, para las propiedades electrónicas de los donantes / aceptores en semiconductores y para las propiedades electrónicas de los fullerenos endoédricos. Sustitución del marco con banda W ENDOR se ha utilizado para proporcionar pruebas experimentales de que un ión metálico se encuentra en el marco tetraédrico y no en una posición de intercambio catiónico. La incorporación de complejos de metales de transición en el marco de los tamices moleculares es importante, ya que podría conducir al desarrollo de nuevos materiales con propiedades catalíticas. El ENDOR aplicado a los radicales atrapados se ha utilizado para estudiar NO con iones metálicos en la química de coordinación, catálisis y bioquímica.
capa de electrones , o un nivel de energía principal , puede considerarse como una órbita seguida por electrones alrededor del núcleo de un átomo . La capa más cercana al núcleo se llama " shell 1 " (también llamada "shell K"), seguida de la " shell 2 " (o "shell L"), luego la " shell 3 " (o "shell M") , y así sucesivamente más y más lejos del núcleo. Las conchas se corresponden con los números cuánticos principales ( n = 1, 2, 3, 4 ...Notación de rayos X (K, L, M, ...).
Cada cubierta puede contener solo un número fijo de electrones: la primera cubierta puede contener hasta dos electrones, la segunda cubierta puede contener hasta ocho (2 + 6) electrones, la tercera cubierta puede contener hasta 18 (2 + 6 + 10) ) y así. La fórmula general es que la carcasa n puede en principio contener hasta 2 ( n 2 ) electrones. [1] Dado que los electrones son atraídos eléctricamente hacia el núcleo, los electrones de un átomo generalmente ocuparán capas externas solo si las capas más internas ya han sido completamente llenas por otros electrones. Sin embargo, este no es un requisito estricto: los átomos pueden tener dos o incluso tres cubiertas externas incompletas. (Ver la regla de Madelungpara más detalles.) Para una explicación de por qué los electrones existen en estas capas, consulte la configuración electrónica . [2]
Los electrones en la capa ocupada más externa (o capas) determinan las propiedades químicas del átomo; Se llama la concha de valencia .
Historia
La terminología de shell viene de la modificación de Arnold Sommerfeld del modelo de Bohr . Sommerfeld conservó el modelo planetario de Bohr, pero agregó órbitas ligeramente elípticas (caracterizadas por números cuánticos adicionales ℓ y m ) para explicar la estructura espectroscópica fina de algunos elementos. [3] Los múltiples electrones con el mismo número cuántico principal ( n ) tenían órbitas cercanas que formaban una "capa" de grosor positivo en lugar de la órbita circular infinitamente delgada del modelo de Bohr.
La existencia de capas de electrones se observó primero experimentalmente en Charles Barkla 's y Henry Moseley ' s de rayos X estudios de absorción. Barkla los etiquetó con las letras K, L, M, N, O, P y Q. [4] El origen de esta terminología fue alfabético. También se sospechó una serie "J", aunque experimentos posteriores indicaron que las líneas de absorción de K son producidas por los electrones más internos. Posteriormente se encontró que estas letras correspondían a los valores n 1, 2, 3, etc. Se usan en la notación espectroscópica de Siegbahn .
El químico físico Gilbert Lewis fue responsable de gran parte del desarrollo temprano de la teoría de la participación de los electrones de la valencia en los enlaces químicos. Linus Pauling más tarde generalizó y extendió la teoría mientras aplicaba los conocimientos de la mecánica cuántica .
Conchas
Las envolturas de electrones están etiquetadas como K, L, M, N, O, P y Q; o 1, 2, 3, 4, 5, 6 y 7; Yendo desde el interior del caparazón hacia afuera. Los electrones en las capas externas tienen una energía promedio más alta y viajan más lejos del núcleo que los de las capas internas. Esto los hace más importantes para determinar cómo el átomo reacciona químicamente y se comporta como un conductor, porque la fuerza del núcleo del átomo sobre ellos es más débil y más fácil de romper. De esta manera, la reactividad de un elemento dado depende en gran medida de su configuración electrónica.
Subshells
Cada shell está compuesto de una o más subshells, que a su vez están compuestas de orbitales atómicos . Por ejemplo, el primer shell (K) tiene una subshell, llamada 1s ; el segundo shell (L) tiene dos subshells, llamados 2s y 2p ; el tercer shell tiene 3s , 3p y 3d ; la cuarta carcasa tiene 4s , 4p , 4d y 4f ; la quinta carcasa tiene 5s , 5p , 5dy 5f y teóricamente puede contener más en 5gsubshell que no está ocupada en la configuración electrónica de estado fundamental de ningún elemento conocido. [2] Las diversas subshells posibles se muestran en la siguiente tabla:
| Etiqueta subshell | ℓ | Electrones max | Conchas que lo contienen | Nombre historico |
|---|---|---|---|---|
| s | 0 | 2 | Cada cáscara | s arpa |
| pag | 1 | 6 | 2do shell y superior | p rincipal |
| re | 2 | 10 | 3ª concha y superior | d iffuse |
| F | 3 | 14 | 4ta cáscara y más alto | f no perjudicial |
| sol | 4 | 18 | 5º shell y superior (teóricamente) | (Siguiente en el alfabeto después de f , excluyendo j ) [5] |
- La primera columna es la "etiqueta de subshell", una etiqueta de letras minúsculas para el tipo de subshell. Por ejemplo, la " subshell 4s " es una subshell de la cuarta (N) shell, con el tipo ( s ) descrito en la primera fila.
- La segunda columna es el número cuántico azimutal () de la subshell. La definición precisa involucra la mecánica cuántica , pero es un número que caracteriza a la subshell.
- La tercera columna es el número máximo de electrones que se pueden colocar en una subshell de ese tipo. Por ejemplo, la fila superior dice que cada subshell de tipo s ( 1s , 2s , etc.) puede tener como máximo dos electrones en ella. En cada caso la figura es 4 mayor que la que está arriba.
- La cuarta columna dice qué shells tienen una subshell de ese tipo. Por ejemplo, mirando a las dos primeras filas, cada cáscara tiene una s subcapa, mientras que sólo la segunda cáscara y superior tienen un p subcapa (es decir, no hay ninguna subcapa "1P").
- La columna final da el origen histórico de las etiquetas s , p , d , y f . Provienen de estudios tempranos de líneas espectrales atómicas . Las otras etiquetas, a saber g , h e i , son una continuación alfabética que sigue a la última etiqueta de origen histórico de f .
Aunque comúnmente se afirma que todos los electrones en una capa tienen la misma energía, esto es una aproximación. Sin embargo, los electrones en una subshell tienen exactamente el mismo nivel de energía, [6] con subshells posteriores que tienen más energía por electrón que los anteriores. Este efecto es lo suficientemente grande como para que los rangos de energía asociados con las conchas puedan superponerse (vea las conchas de valencia y el principio de Aufbau ).
Número de electrones en cada capa.
Nombre de shell | Nombre de subshell | Subshell max electrones | Shell max electrones |
|---|---|---|---|
| K | 1s | 2 | 2 |
| L | 2s | 2 | 2 + 6 = 8 |
| 2p | 6 | ||
| METRO | 3s | 2 | 2 + 6 + 10 = 18 |
| 3p | 6 | ||
| 3d | 10 | ||
| norte | 4s | 2 | 2 + 6 + 10 + 14 = 32 |
| 4p | 6 | ||
| 4d | 10 | ||
| 4f | 14 | ||
| O | 5s | 2 | 2 + 6 + 10 + 14 + 18 = 50 |
| 5p | 6 | ||
| 5d | 10 | ||
| 5f | 14 | ||
| 5g | 18 |
Cada subshell está restringida para contener 4 ℓ + 2 electrones como máximo, a saber:
- Cada s del subnivel mantiene como máximo 2 electrones
- Cada sub-capa p tiene como máximo 6 electrones.
- Cada d subnivel tiene como máximo 10 electrones
- Cada f subcapa tiene como máximo 14 electrones
- Cada subshell g tiene como máximo 18 electrones
Por lo tanto, la cáscara K, que contiene solo una subshell s , puede contener hasta 2 electrones; la capa L, que contiene una s y una p , puede contener hasta 2 + 6 = 8 electrones, etc. En general, la carcasa npuede contener hasta 2 n 2 electrones. [1]
Aunque esa fórmula da el máximo en principio, de hecho ese máximo solo se alcanza (por elementos conocidos) para las primeras cuatro carcasas (K, L, M, N). Ningún elemento conocido tiene más de 32 electrones en una capa. [7] [8] Esto se debe a que las subshells se llenan de acuerdo con el principio de Aufbau . Los primeros elementos que tengan más de 32 electrones en una capa pertenecerían al bloque g del período 8de la tabla periódica . Estos elementos tendrían algunos electrones en su subcasa de 5 g y, por lo tanto, tendrían más de 32 electrones en la cáscara O (quinta capa principal).
Cáscara de valencia
La cáscara de valencia es la cáscara más externa de un átomo . Los electrones de valencia en elementos de metal no de transición residen en esta capa. Dichos elementos con carcasas de valencia completas ( gases nobles ) son los más químicamente no reactivos, mientras que aquellos con solo un electrón en sus carcasas de valencia ( metales alcalinos ) o que simplemente faltan un electrón para tener una cáscara completa ( halógenos) son los más reactivos. [9]
Sin embargo, esta terminología es algo engañosa en el caso de los metales de transición. En estos elementos, un electrón de valencia también puede estar en una capa interna. Por lo tanto, los electrones que determinan cómo reacciona químicamente un átomo son aquellos que viajan más lejos del núcleo, es decir, aquellos con la energía más alta , y no necesariamente en la capa de valencia.
Lista de elementos con electrones por concha.
La siguiente lista muestra los elementos organizados al aumentar el número atómico y muestra el número de electrones por capa. De un vistazo, se puede ver que los subconjuntos de la lista muestran patrones obvios. En particular, los siete elementos (en azul eléctrico) antes de un gas noble (grupo 18, en amarillo) más alto que el helio tienen el número de electrones en la capa de valencia en la progresión aritmética . (Sin embargo, este patrón puede romperse en el séptimo período debido a los efectos relativistas ).
La clasificación de la tabla por grupo químico muestra patrones adicionales, especialmente con respecto a las dos últimas carcasas más externas. (Los elementos 57 a 71 pertenecen a los lantánidos , mientras que 89 a 103 son los actínidos ).
La siguiente lista es principalmente consistente con el principio de Aufbau . Sin embargo, hay una serie de excepciones a la regla; por ejemplo, el paladio (número atómico 46) no tiene electrones en la quinta capa, a diferencia de otros átomos con un número atómico más bajo . Algunas entradas en la tabla son inciertas, cuando los datos experimentales no están disponibles. (Por ejemplo, los elementos más allá de 108 tienen vidas mediastan cortas que sus configuraciones electrónicas aún no se han medido).
| Z | Elemento | No. de electrones / cáscara | Grupo |
|---|---|---|---|
| 1 | Hidrógeno | 1 | 1 |
| 2 | Helio | 2 | 18 |
| 3 | Litio | 2, 1 | 1 |
| 4 | Berilio | 2, 2 | 2 |
| 5 | Boro | 2, 3 | 13 |
| 6 | Carbón | 2, 4 | 14 |
| 7 | Nitrógeno | 2, 5 | 15 |
| 8 | Oxígeno | 2, 6 | dieciséis |
| 9 | Flúor | 2, 7 | 17 |
| 10 | Neón | 2, 8 | 18 |
| 11 | Sodio | 2, 8, 1 | 1 |
| 12 | Magnesio | 2, 8, 2 | 2 |
| 13 | Aluminio | 2, 8, 3 | 13 |
| 14 | Silicio | 2, 8, 4 | 14 |
| 15 | Fósforo | 2, 8, 5 | 15 |
| dieciséis | Azufre | 2, 8, 6 | dieciséis |
| 17 | Cloro | 2, 8, 7 | 17 |
| 18 | Argón | 2, 8, 8 | 18 |
| 19 | Potasio | 2, 8, 8, 1 | 1 |
| 20 | Calcio | 2, 8, 8, 2 | 2 |
| 21 | Escandio | 2, 8, 9, 2 | 3 |
| 22 | Titanio | 2, 8, 10, 2 | 4 |
| 23 | Vanadio | 2, 8, 11, 2 | 5 |
| 24 | Cromo | 2, 8, 13, 1 | 6 |
| 25 | Manganeso | 2, 8, 13, 2 | 7 |
| 26 | Planchar | 2, 8, 14, 2 | 8 |
| 27 | Cobalto | 2, 8, 15, 2 | 9 |
| 28 | Níquel | 2, 8, 16, 2 | 10 |
| 29 | Cobre | 2, 8, 18, 1 | 11 |
| 30 | Zinc | 2, 8, 18, 2 | 12 |
| 31 | Galio | 2, 8, 18, 3 | 13 |
| 32 | Germanio | 2, 8, 18, 4 | 14 |
| 33 | Arsénico | 2, 8, 18, 5 | 15 |
| 34 | Selenio | 2, 8, 18, 6 | dieciséis |
| 35 | Bromo | 2, 8, 18, 7 | 17 |
| 36 | Criptón | 2, 8, 18, 8 | 18 |
| 37 | Rubidio | 2, 8, 18, 8, 1 | 1 |
| 38 | Estroncio | 2, 8, 18, 8, 2 | 2 |
| 39 | Itrio | 2, 8, 18, 9, 2 | 3 |
| 40 | Circonio | 2, 8, 18, 10, 2 | 4 |
| 41 | Niobio | 2, 8, 18, 12, 1 | 5 |
| 42 | Molibdeno | 2, 8, 18, 13, 1 | 6 |
| 43 | Tecnecio | 2, 8, 18, 13, 2 | 7 |
| 44 | Rutenio | 2, 8, 18, 15, 1 | 8 |
| 45 | Rodio | 2, 8, 18, 16, 1 | 9 |
| 46 | Paladio | 2, 8, 18, 18 | 10 |
| 47 | Plata | 2, 8, 18, 18, 1 | 11 |
| 48 | Cadmio | 2, 8, 18, 18, 2 | 12 |
| 49 | Indio | 2, 8, 18, 18, 3 | 13 |
| 50 | Estaño | 2, 8, 18, 18, 4 | 14 |
| 51 | Antimonio | 2, 8, 18, 18, 5 | 15 |
| 52 | Telurio | 2, 8, 18, 18, 6 | dieciséis |
| 53 | Yodo | 2, 8, 18, 18, 7 | 17 |
| 54 | Xenón | 2, 8, 18, 18, 8 | 18 |
| 55 | Cesio | 2, 8, 18, 18, 8, 1 | 1 |
| 56 | Bario | 2, 8, 18, 18, 8, 2 | 2 |
| 57 | Lantano | 2, 8, 18, 18, 9, 2 | 3 |
| 58 | Cerio | 2, 8, 18, 19, 9, 2 | |
| 59 | Praseodimio | 2, 8, 18, 21, 8, 2 | |
| 60 | Neodimio | 2, 8, 18, 22, 8, 2 | |
| 61 | Prometeo | 2, 8, 18, 23, 8, 2 | |
| 62 | Samario | 2, 8, 18, 24, 8, 2 | |
| 63 | Europio | 2, 8, 18, 25, 8, 2 | |
| 64 | Gadolinio | 2, 8, 18, 25, 9, 2 | |
| sesenta y cinco | Terbio | 2, 8, 18, 27, 8, 2 | |
| 66 | Disprosio | 2, 8, 18, 28, 8, 2 | |
| 67 | Holmio | 2, 8, 18, 29, 8, 2 | |
| 68 | Erbio | 2, 8, 18, 30, 8, 2 | |
| 69 | Tulio | 2, 8, 18, 31, 8, 2 | |
| 70 | Iterbio | 2, 8, 18, 32, 8, 2 | |
| 71 | Lutecio | 2, 8, 18, 32, 9, 2 | |
| 72 | Hafnio | 2, 8, 18, 32, 10, 2 | 4 |
| 73 | Tantalio | 2, 8, 18, 32, 11, 2 | 5 |
| 74 | Tungsteno | 2, 8, 18, 32, 12, 2 | 6 |
| 75 | Renio | 2, 8, 18, 32, 13, 2 | 7 |
| 76 | Osmio | 2, 8, 18, 32, 14, 2 | 8 |
| 77 | Iridio | 2, 8, 18, 32, 15, 2 | 9 |
| 78 | Platino | 2, 8, 18, 32, 17, 1 | 10 |
| 79 | Oro | 2, 8, 18, 32, 18, 1 | 11 |
| 80 | Mercurio | 2, 8, 18, 32, 18, 2 | 12 |
| 81 | Talio | 2, 8, 18, 32, 18, 3 | 13 |
| 82 | Dirigir | 2, 8, 18, 32, 18, 4 | 14 |
| 83 | Bismuto | 2, 8, 18, 32, 18, 5 | 15 |
| 84 | Polonio | 2, 8, 18, 32, 18, 6 | dieciséis |
| 85 | Astatine | 2, 8, 18, 32, 18, 7 | 17 |
| 86 | Radón | 2, 8, 18, 32, 18, 8 | 18 |
| 87 | Francium | 2, 8, 18, 32, 18, 8, 1 | 1 |
| 88 | Radio | 2, 8, 18, 32, 18, 8, 2 | 2 |
| 89 | Actinio | 2, 8, 18, 32, 18, 9, 2 | 3 |
| 90 | Torio | 2, 8, 18, 32, 18, 10, 2 | |
| 91 | Protactinio | 2, 8, 18, 32, 20, 9, 2 | |
| 92 | Uranio | 2, 8, 18, 32, 21, 9, 2 | |
| 93 | Neptunio | 2, 8, 18, 32, 22, 9, 2 | |
| 94 | Plutonio | 2, 8, 18, 32, 24, 8, 2 | |
| 95 | Americio | 2, 8, 18, 32, 25, 8, 2 | |
| 96 | Curio | 2, 8, 18, 32, 25, 9, 2 | |
| 97 | Berkelio | 2, 8, 18, 32, 27, 8, 2 | |
| 98 | Californio | 2, 8, 18, 32, 28, 8, 2 | |
| 99 | Einsteinium | 2, 8, 18, 32, 29, 8, 2 | |
| 100 | Fermio | 2, 8, 18, 32, 30, 8, 2 | |
| 101 | Mendelevio | 2, 8, 18, 32, 31, 8, 2 | |
| 102 | Nobelio | 2, 8, 18, 32, 32, 8, 2 | |
| 103 | Lawrencium | 2, 8, 18, 32, 32, 8, 3 | |
| 104 | Rutherfordium | 2, 8, 18, 32, 32, 10, 2 | 4 |
| 105 | Dubnio | 2, 8, 18, 32, 32, 11, 2 | 5 |
| 106 | Seaborgium | 2, 8, 18, 32, 32, 12, 2 | 6 |
| 107 | Bohrium | 2, 8, 18, 32, 32, 13, 2 | 7 |
| 108 | Hassium | 2, 8, 18, 32, 32, 14, 2 | 8 |
| 109 | Meitnerio | 2, 8, 18, 32, 32, 15, 2 (?) | 9 |
| 110 | Darmstadtium | 2, 8, 18, 32, 32, 16, 2 (?) | 10 |
| 111 | Roentgenium | 2, 8, 18, 32, 32, 17, 2 (?) | 11 |
| 112 | Copernicio | 2, 8, 18, 32, 32, 18, 2 (?) | 12 |
| 113 | Nihonio | 2, 8, 18, 32, 32, 18, 3 (?) | 13 |
| 114 | Flerovium | 2, 8, 18, 32, 32, 18, 4 (?) | 14 |
| 115 | Moscovio | 2, 8, 18, 32, 32, 18, 5 (?) | 15 |
| 116 | Livermorium | 2, 8, 18, 32, 32, 18, 6 (?) | dieciséis |
| 117 | Tennessine | 2, 8, 18, 32, 32, 18, 7 (?) | 17 |
| 118 | Oganesson | 2, 8, 18, 32, 32, 18, 8 (?) | 18 |






















No hay comentarios:
Publicar un comentario