Historia [ editar ]
Los primeros descubrimientos [ editar ]
En 1529, Georgius Agricola describió la fluorita como un aditivo usado para bajar el punto de fusión de los metales durante la fundición . [69] [70] [nota 5] Escribió la palabra latina fluorés ( flúor, flujo) para rocas de fluorita. El nombre más tarde evolucionó a fluorita (todavía se usa comúnmente) y luego a fluorita . [62] [74] [75] Posteriormente se determinó que la composición de fluorita era difluoruro de calcio . [76]
El ácido fluorhídrico se usó en el grabado de vidrio desde 1720 en adelante. [nota 6] Andreas Sigismund Marggraf lo caracterizó por primera vez en 1764 cuando calentó fluorita con ácido sulfúrico, y la solución resultante corroía su recipiente de vidrio. [78] [79] El químico sueco Carl Wilhelm Scheele repitió el experimento en 1771, y llamó al producto ácido fluss-spats-syran (ácido fluorado ). [79] [80] En 1810, el físico francés André-Marie Ampère sugirió que el hidrógeno y un elemento análogo al cloro constituían ácido fluorhídrico. [81] Sir Humphry Davypropuso que esta sustancia entonces desconocido ser nombrado flúor a partir de ácido fluórico y el ine sufijo de otros halógenos. Esta palabra, con modificaciones, se usa en la mayoría de las lenguas europeas; Griego, ruso y algunos otros (siguiendo la sugerencia de Ampère) utilizan el nombre ftor o derivados, del griego φθόριος ( phthorios , destructive). [82] [83] El nuevo nombre latino fluorum dio al elemento su símbolo actual F ; Fl fue utilizado en los primeros papeles. [84] [nota 7]
Aislamiento [ editar ]
Los estudios iniciales sobre el flúor fueron tan peligrosos que varios experimentadores del siglo XIX fueron considerados "mártires del flúor" después de desgracias con el ácido fluorhídrico. [nota 8] El aislamiento del flúor elemental se vio obstaculizado por la extrema corrosividad del flúor elemental y el fluoruro de hidrógeno, así como por la falta de un electrolito simple y adecuado . [76] [85] Edmond Frémy postuló que la electrólisis de fluoruro de hidrógeno puro para generar flúor era factible y ideó un método para producir muestras anhidras a partir de bifluoruro de potasio acidificado ; en cambio, descubrió que el fluoruro de hidrógeno resultante (seco) no conducía la electricidad. [76][85] [86] El ex alumno de Frémy, Henri Moissan , perseveró, y después de muchas pruebas y errores encontró que una mezcla de bifluoruro de potasio y fluoruro de hidrógeno seco era un conductor, lo que permitía la electrólisis. Para evitar la rápida corrosión del platino en sus células electroquímicas, enfrió la reacción a temperaturas extremadamente bajas en un baño especial y forjó células a partir de una mezcla más resistente de platino e iridio , y utilizó tapones de fluorita. [85] [87] En 1886, después de 74 años de esfuerzo por parte de muchos químicos, Moissan aisló flúor elemental. [86] [88]
En 1906, dos meses antes de su muerte, Moissan recibió el Premio Nobel de Química , [89] con la siguiente cita: [85]
Usos posteriores [ editar ]
La división Frigidaire de General Motors (GM) experimentó con refrigerantes de clorofluorocarbono a fines de la década de 1920, y Kinetic Chemicals se formó como una empresa conjunta entre GM y DuPont en 1930 con la esperanza de comercializar Freon-12 ( CCl
2 F
2 ) como uno de esosrefrigerantes. Reemplazó los compuestos anteriores y más tóxicos, incrementó la demanda de refrigeradores de cocina y se volvió rentable; para 1949, DuPont había comprado Kinetic y había comercializado varios otroscompuestos defreón. [79][90][91][92] El politetrafluoroetileno(teflón) fue descubierto accidentalmente en 1938 porRoy J. Plunkettmientras trabajaba con refrigerantes en Kinetic, y su resistencia química y térmica superlativa lo aceleró en la comercialización y producción en masa en 1941 .[79][90][91]
2 F
2 ) como uno de esosrefrigerantes. Reemplazó los compuestos anteriores y más tóxicos, incrementó la demanda de refrigeradores de cocina y se volvió rentable; para 1949, DuPont había comprado Kinetic y había comercializado varios otroscompuestos defreón. [79][90][91][92] El politetrafluoroetileno(teflón) fue descubierto accidentalmente en 1938 porRoy J. Plunkettmientras trabajaba con refrigerantes en Kinetic, y su resistencia química y térmica superlativa lo aceleró en la comercialización y producción en masa en 1941 .[79][90][91]
La producción a gran escala de flúor elemental comenzó durante la Segunda Guerra Mundial. Alemania utilizó la electrólisis a alta temperatura para producir toneladas del trifluoruro de cloro incendiario [93] y el Proyecto Manhattan utilizó enormes cantidades para producir hexafluoruro de uranio para el enriquecimiento de uranio. Desde la UF
6 es tan corrosivo como el flúor,lasplantas dedifusión gaseosarequerían materiales especiales: níquel para membranas, fluoropolímeros para sellos y fluorocarburos líquidos como refrigerantes y lubricantes. Esta floreciente industria nuclear condujo más tarde el desarrollo de productos químicos de la posguerra durante la guerra. [94]
6 es tan corrosivo como el flúor,lasplantas dedifusión gaseosarequerían materiales especiales: níquel para membranas, fluoropolímeros para sellos y fluorocarburos líquidos como refrigerantes y lubricantes. Esta floreciente industria nuclear condujo más tarde el desarrollo de productos químicos de la posguerra durante la guerra. [94]
Compuestos [ editar ]
El flúor tiene una rica química, que abarca dominios orgánicos e inorgánicos. Se combina con metales, no metales, metaloides y la mayoría de los gases nobles, [95] y casi exclusivamente asume un estado de oxidaciónde -1. [nota 10] La alta afinidad electrónica del flúor da lugar a una preferencia por la unión iónica ; Cuando forma enlaces covalentes , estos son polares, y casi siempre solos . [98] [99] [nota 11]
Metales [ editar ]
Los metales alcalinos forman monofluoruros iónicos y altamente solubles ; Estos tienen la disposición cúbica de cloruro de sodio y cloruros análogos. [100] [101] Los difluoruros alcalinotérreos poseen enlaces iónicos fuertes pero son insolubles en agua, [84] con la excepción del difluoruro de berilio , que también exhibe algún carácter covalente y tiene una estructura similar al cuarzo . [102] Los elementos de tierras raras y muchos otros metales forman en su mayoría trifluoruros iónicos . [103] [104] [105]
El enlace covalente primero cobra importancia en los tetrafluoruros : los de circonio , hafnio [106] [107] y varios actínidos [108] son iónicos con altos puntos de fusión, [109] [nota 12], mientras que los de titanio , [112] vanadio , [113]y niobio son polímeros, [114] se funden o se descomponen a no más de 350 ° C (660 ° F). [115] Los pentafluoruroscontinúan esta tendencia con sus polímeros lineales y complejos oligoméricos . [116] [117][118] Se conocentrecehexafluoruros metálicos, [nota 13] todos octaédricos, y son en su mayoría sólidos volátiles, pero para MoF líquido
6yReF
6 , yWFgaseoso
6 . [119][120][121] El heptafluoruro de renio, el únicoheptafluorurometálico caracterizado, es un sólido molecular de bajo punto de fusión congeometría molecular bipiramidal pentagonal. [122]Los fluoruros metálicos con más átomos de flúor son particularmente reactivos. [123]
6yReF
6 , yWFgaseoso
6 . [119][120][121] El heptafluoruro de renio, el únicoheptafluorurometálico caracterizado, es un sólido molecular de bajo punto de fusión congeometría molecular bipiramidal pentagonal. [122]Los fluoruros metálicos con más átomos de flúor son particularmente reactivos. [123]
| Progresión estructural de los fluoruros metálicos. | ||
 |  |  |
| Fluoruro de sodio, ionico | Pentafluoruro de bismuto, polimérico | Heptafluoruro de renio, molecular |
Hidrógeno [ editar ]
El hidrógeno y el flúor se combinan para producir fluoruro de hidrógeno, en el que las moléculas discretas forman grupos por enlaces de hidrógeno, que se parecen más al agua que al cloruro de hidrógeno . [124] [125] [126] Hierve a una temperatura mucho más alta que los haluros de hidrógeno más pesados y, a diferencia de ellos, es completamente miscible con agua. [127] El fluoruro de hidrógeno se hidrata fácilmente en contacto con el agua para formar fluoruro de hidrógeno acuoso, también conocido como ácido fluorhídrico. A diferencia de los otros ácidos hidrohálicos, que son fuertes , el ácido fluorhídrico es un ácido débil en bajas concentraciones. [128] [nota 14] Sin embargo, puede atacar el vidrio, algo que los otros ácidos no pueden hacer.[130]
Otros no metales reactivos [ editar ]
- Los metaloides están incluidos en esta sección.
Los fluoruros binarios de metaloides y no metales p-block son generalmente covalentes y volátiles, con reactividades variables. Período 3 y no metales más pesados pueden formar fluoruros hipervalentes . [132]
El trifluoruro de boro es plano y posee un octeto incompleto. Funciona como un ácido de Lewis y se combina con bases de Lewis como el amoníaco para formar aductos . [133] El tetrafluoruro de carbono es tetraédrico e inerte; [nota 15] sus análogos de grupo , el silicio y el tetrafluoruro de germanio, también son tetraédricos [134] pero se comportan como ácidos de Lewis. [135] [136] Los nictógenos forman trifluoruros que aumentan en reactividad y basicidad con mayor peso molecular, aunque el trifluoruro de nitrógeno es resistente a la hidrólisis y no es básico. [137]Los pentafluoruros de fósforo, arsénico y antimonio son más reactivos que sus respectivos trifluoruros, siendo el pentafluoruro de antimonio el ácido de Lewis neutro más fuerte conocido. [116] [138] [139]
Los calcógenos tienen diversos fluoruros: se han reportado difluoruros inestables para el oxígeno (el único compuesto conocido con oxígeno en un estado de oxidación de +2), azufre y selenio; Existen tetrafluoruros y hexafluoruros para el azufre, el selenio y el teluro. Estos últimos están estabilizados por más átomos de flúor y átomos centrales más ligeros, por lo que el hexafluoruro de azufre es especialmente inerte. [140] [141] El cloro, el bromo y el yodo pueden formar mono-, tri- y pentafluoruros, pero solo el heptafluoruro de yodo se ha caracterizado entre los posibles heptafluoruros interhalógenos . [142]Muchos de ellos son fuentes poderosas de átomos de flúor, y las aplicaciones industriales que usan trifluoruro de cloro requieren precauciones similares a las que usan flúor. [143] [144]
Gases nobles [ editar ]
Los gases nobles , que tienen capas de electrones completas, desafiaron la reacción con otros elementos hasta 1962 cuando Neil Bartlett informó la síntesis de hexafluoroplatinato de xenón ; [146] El difluoruro de xenón , el tetrafluoruro , el hexafluoruro y los múltiples oxifluoruros se han aislado desde entonces. [147] Entre otros gases nobles, el criptón forma un difluoruro , [148] y el radón y el flúor generan un sólido sospechoso de ser difluoruro de radón . [149] [150]Los fluoruros binarios de gases nobles más ligeros son excepcionalmente inestables: el argón y el fluoruro de hidrógeno se combinan en condiciones extremas para producir fluorohidruro de argón . [39] El helio y el neón no tienen fluoruros de larga duración, [151] y nunca se ha observado fluoruro de neón; [152]Fluorohidruro de helio ha sido detectado por milisegundos a altas presiones y bajas temperaturas. [151]
Compuestos organicos [ editar ]
El enlace carbono-flúor es el más fuerte de la química orgánica , [154] y le da estabilidad a los organofluoros. [155] Es casi inexistente en la naturaleza, pero se usa en compuestos artificiales. La investigación en esta área es generalmente impulsada por aplicaciones comerciales; [156]los compuestos involucrados son diversos y reflejan la complejidad inherente a la química orgánica. [90]
Moléculas discretas [ editar ]
La sustitución de átomos de hidrógeno en un alcano por más átomos de flúor gradualmente altera varias propiedades: se reducen los puntos de fusión y de ebullición, aumenta la densidad, disminuye la solubilidad en hidrocarburos y aumenta la estabilidad general. Los perfluorocarbonos, [nota 16] en los cuales todos los átomos de hidrógeno están sustituidos, son insolubles en la mayoría de los solventes orgánicos, reaccionando en condiciones ambientales solo con sodio en amoníaco líquido. [157]
El término compuesto perfluorado se usa para lo que de otro modo sería un perfluorocarbono si no fuera por la presencia de un grupo funcional , [158] [nota 17] a menudo un ácido carboxílico . Estos compuestos comparten muchas propiedades con los perfluorocarbonos, como la estabilidad y la hidrofobicidad , [160] mientras que el grupo funcional aumenta su reactividad, lo que les permite adherirse a las superficies o actuar como surfactantes ; [161] Los fluorosurfactantes , en particular, pueden disminuir la tensión superficial del agua más que sus análogos basados en hidrocarburos. Fluorotelómeros, que tienen algunos átomos de carbono no fluorados cerca del grupo funcional, también se consideran perfluorados. [160]
Polímeros [ editar ]
Los polímeros exhiben los mismos aumentos de estabilidad proporcionados por la sustitución con flúor (para el hidrógeno) en moléculas discretas; sus puntos de fusión generalmente aumentan también. [162]Politetrafluoroetileno (PTFE), el fluoropolímero más simple y análogo de perfluoro del polietileno con unidad estructural - CF
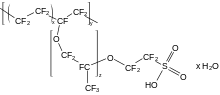
2 -, demuestra este cambio como se esperaba, pero su punto de fusión muy alto dificulta el moldeo. [163] Varios derivados de PTFE son menos tolerantes a la temperatura, pero más fácil de moldear:etileno propileno fluoradoreemplaza algunos átomos de flúor contrifluorometilogrupos,alcanos perfluoroalcoxihacen lo mismo contrifluorometoxigrupos, [163] yNafioncontiene cadenas laterales perfluoroéter tapados conácido sulfónicogrupos . [164] [165] Otros fluoropolímeros retienen algunos átomos de hidrógeno; El fluoruro de polivinilidenotiene la mitad de los átomos de flúor de PTFE yEl fluoruro de polivinilo tiene un cuarto, pero ambos se comportan de manera muy similar a los polímeros perfluorados.
2 -, demuestra este cambio como se esperaba, pero su punto de fusión muy alto dificulta el moldeo. [163] Varios derivados de PTFE son menos tolerantes a la temperatura, pero más fácil de moldear:etileno propileno fluoradoreemplaza algunos átomos de flúor contrifluorometilogrupos,alcanos perfluoroalcoxihacen lo mismo contrifluorometoxigrupos, [163] yNafioncontiene cadenas laterales perfluoroéter tapados conácido sulfónicogrupos . [164] [165] Otros fluoropolímeros retienen algunos átomos de hidrógeno; El fluoruro de polivinilidenotiene la mitad de los átomos de flúor de PTFE yEl fluoruro de polivinilo tiene un cuarto, pero ambos se comportan de manera muy similar a los polímeros perfluorados.








No hay comentarios:
Publicar un comentario