El yodo es un elemento químico con el símbolo I y el número atómico 53. El halógeno más pesado de los estables , existe como un sólido no metálico brillante, púrpura-negro en condiciones estándar que se funde para formar un líquido violeta profundo a 114 grados centígrados, y Se reduce a un gas violeta a 184 grados centígrados. El elemento fue descubierto por el químico francés Bernard Courtois en 1811. Fue nombrado dos años más tarde por Joseph Louis Gay-Lussac de esta propiedad, después del griego ἰώδης "de color violeta".
El yodo se produce en muchos estados de oxidación, incluido el yoduro (I - ), el yodato ( IO -
3 ) y los diversos aniones de periodato. Es el menos abundante de los halógenos estables, siendo el elemento más abundante en el sesenta y uno. Es el nutriente mineral esencial más pesado . El yodo es esencial en la síntesis de hormonas tiroideas . [4] La deficiencia de yodo afecta a cerca de dos mil millones de personas y es la principal causa prevenible de discapacidad intelectual .
3 ) y los diversos aniones de periodato. Es el menos abundante de los halógenos estables, siendo el elemento más abundante en el sesenta y uno. Es el nutriente mineral esencial más pesado . El yodo es esencial en la síntesis de hormonas tiroideas . [4] La deficiencia de yodo afecta a cerca de dos mil millones de personas y es la principal causa prevenible de discapacidad intelectual .
Los productores dominantes de yodo en la actualidad son Chile y Japón. El yodo y sus compuestos se utilizan principalmente en nutrición . Debido a su alto número atómico y la facilidad de adhesión a los compuestos orgánicos , también se ha encontrado a favor como un material de radiocontraste no tóxico . Debido a la especificidad de su absorción por el cuerpo humano, los isótopos radiactivos del yodo también se pueden usar para tratar el cáncer de tiroides . El yodo también se usa como catalizador en la producción industrial de ácido acético y algunos polímeros .
 | |||||||||||||||
| Yodo | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciación | / Aɪ ə d aɪ n , | ||||||||||||||
| Apariencia | Lustroso gris metalizado, violeta como gas. | ||||||||||||||
| Peso atómico estándar A r, std (I) | 126.904 47 (3) [1] | ||||||||||||||
| Yodo en la tabla periódica. | |||||||||||||||
| |||||||||||||||
| Número atómico ( z ) | 53 | ||||||||||||||
| Grupo | grupo 17 (halógenos) | ||||||||||||||
| Período | periodo 5 | ||||||||||||||
| Bloquear | bloque p | ||||||||||||||
| Categoría de elemento | no metal reactivo | ||||||||||||||
| Configuración electronica | [ Kr ] 4d 10 5s 2 5p 5 | ||||||||||||||
Electrones por concha
| 2, 8, 18, 18, 7 | ||||||||||||||
| Propiedades físicas | |||||||||||||||
| Fase en STP | sólido | ||||||||||||||
| Punto de fusion | 386.85 K (113.7 ° C, 236.66 ° F) | ||||||||||||||
| Punto de ebullición | 457.4 K (184.3 ° C, 363.7 ° F) | ||||||||||||||
| Densidad (cerca de rt ) | 4.933 g / cm 3 | ||||||||||||||
| Triple punto | 386.65 K, 12.1 kPa | ||||||||||||||
| Punto crítico | 819 K, 11.7 MPa | ||||||||||||||
| Calor de fusión | (I 2 ) 15.52 kJ / mol | ||||||||||||||
| Calor de vaporización. | (I 2 ) 41.57 kJ / mol | ||||||||||||||
| Capacidad de calor molar | (I 2 ) 54.44 J / (mol · K) | ||||||||||||||
Presión de vapor (rombal)
| |||||||||||||||
| Propiedades atómicas | |||||||||||||||
| Estados de oxidación | −1 , +1 , +3 , +4, +5 , +6, +7(unóxidofuertemente ácido ) | ||||||||||||||
| Electronegatividad | Escala de Pauling: 2,66 | ||||||||||||||
| Energías de ionización |
| ||||||||||||||
| Radio atómico | empírico: 140 hs. | ||||||||||||||
| Radio covalente | 139 ± 3 pm | ||||||||||||||
| Radio de van der waals | 198 pm | ||||||||||||||
Historia [ editar ]
En 1811, el yodo fue descubierto por el químico francés Bernard Courtois , [5] [6] que nació para un fabricante de salitre (un componente esencial de la pólvora ). En el momento de las guerras napoleónicas, el salitre era muy solicitado en Francia. El salitre producido a partir de lechos de nitro francés requería carbonato de sodio , que podía aislarse de las algasrecolectadas en las costas de Normandía y Bretaña . Para aislar el carbonato de sodio, las algas se quemaron y la ceniza se lavó con agua. Los residuos restantes se destruyeron añadiendo ácido sulfúrico.. Courtois una vez agregó un exceso de ácido sulfúrico y una nube de vapor púrpura se levantó. Notó que el vapor cristalizó en superficies frías, formando cristales oscuros. [7] Courtois sospechaba que este material era un elemento nuevo, pero carecía de fondos para seguir investigándolo. [8]
Courtois dio muestras a sus amigos, Charles Bernard Desormes (1777–1838) y Nicolas Clément (1779–1841), para continuar la investigación. También le dio parte de la sustancia al químico Joseph Louis Gay-Lussac (1778–1850), y al físico André-Marie Ampère(1775–1836). El 29 de noviembre de 1813, Desormes y Clément publicaron el descubrimiento de Courtois. Describieron la sustancia en una reunión del Instituto Imperial de Francia . [9] El 6 de diciembre, Gay-Lussac anunció que la nueva sustancia era un elemento o un compuesto de oxígeno. [10] [11] [12] Fue Gay-Lussac quien sugirió el nombre "iode", de la palabra griega ἰοειδής [13] ( ioeidēs ) para violeta (debido al color del vapor de yodo). [5] [10] Ampère le dio parte de su muestra al químico inglés Humphry Davy (1778–1829), quien experimentó con la sustancia y notó su similitud con el cloro . [14] Davy envió una carta fechada el 10 de diciembre a la Royal Society de Londres indicando que había identificado un nuevo elemento. [15] Los argumentos surgieron entre Davy y Gay-Lussac sobre quién identificó el yodo primero, pero ambos científicos reconocieron a Courtois como el primero en aislar el elemento. [8]
En las primeras tablas periódicas , el yodo a menudo recibe el símbolo J , para jod , su nombre en alemán. [dieciséis]
Propiedades [ editar ]
El yodo es el cuarto halógeno , siendo un miembro del grupo 17 en la tabla periódica, debajo del flúor , el cloro y el bromo ; Es el miembro estable más pesado de su grupo. (El quinto halógeno escaso y fugitivo, el astatino radioactivo , no está bien estudiado debido a su costo e inaccesibilidad en grandes cantidades, pero parece mostrar varias propiedades inusuales debido a los efectos relativistas ). El yodo tiene una configuración electrónica de [Kr] 4d 10 5s 2 5p 5 , con los siete electrones en la quinta capa más externa y sus electrones de valencia. Al igual que los otros halógenos, es un electrón por debajo de un octeto completo y, por lo tanto, es un agente oxidante fuerte, que reacciona con muchos elementos para completar su capa externa, aunque en consonancia con las tendencias periódicas , es el agente oxidante más débil entre los estables. halógenos: tiene la electronegatividadmás baja entre ellos, solo 2.66 en la escala de Pauling (compare el flúor, el cloro y el bromo en 3.98, 3.16 y 2.96 respectivamente; astatine continúa la tendencia con una electronegatividad de 2.2). Por lo tanto, el yodo elemental forma moléculas diatómicas con la fórmula química I 2, donde dos átomos de yodo comparten un par de electrones para lograr cada uno un octeto estable por sí mismos; a altas temperaturas, estas moléculas diatómicas disocian reversiblemente un par de átomos de yodo. Del mismo modo, el anión yoduro, I - , es el agente reductor más fuerte entre los halógenos estables, siendo el más fácilmente oxidado de nuevo a diatómico I 2 . [17] (Astatine va más allá, ya que es inestable como At - y se oxida fácilmente a At 0 o At +, aunque la existencia de At 2 no está resuelta) [18]
Los halógenos se oscurecen a medida que el grupo desciende: el flúor es un gas amarillo muy pálido, el cloro es amarillo verdoso y el bromo es un líquido volátil de color marrón rojizo. El yodo se ajusta a la tendencia predominante, ya que es un sólido cristalino negro brillante que se funde a 114 ° C y hierve a 183 ° C para formar un gas violeta. Esta tendencia se produce porque las longitudes de onda de la luz visible absorbida por los halógenos aumentan hacia abajo en el grupo (aunque Astatine puede no ajustarse a ella, dependiendo de qué tan metálico resulte ser). [17] Específicamente, el color violeta del gas de yodo se debe a la transición electrónicaentre el antígeno molecular de π g ocupado más alto y el anti-enlace vacío más bajo σ uorbital molecular. [19]
El yodo elemental es ligeramente soluble en agua, con un gramo que se disuelve en 3450 ml a 20 ° C y 1280 ml a 50 ° C; Se puede agregar yoduro de potasio para aumentar la solubilidad a través de la formación de iones triyoduro , entre otros poliyoduros. [19] Los disolventes no polares, como el hexano y el tetracloruro de carbono,proporcionan una mayor solubilidad. [20] Las soluciones polares, como las soluciones acuosas, son de color marrón, lo que refleja el papel de estos disolventes como bases de Lewis ; Por otro lado, las soluciones no polares son violetas, del color del vapor de yodo. [19] Complejos de transferencia de cargaSe forma cuando el yodo se disuelve en disolventes polares, cambiando así el color. El yodo es violeta cuando se disuelve en tetracloruro de carbono e hidrocarburos saturados, pero de color marrón oscuro en alcoholes y aminas , disolventes que forman aductos de transferencia de carga. [21]
Los puntos de fusión y ebullición del yodo son los más altos entre los halógenos, de acuerdo con la tendencia creciente del grupo, ya que el yodo tiene la mayor nube de electrones entre ellos que es la más fácilmente polarizada, lo que hace que sus moléculas tengan las interacciones de van der Waals más fuertes . entre los halógenos. Del mismo modo, el yodo es el menos volátil de los halógenos. [17] Debido a que tiene el radio atómico más grande entre los halógenos, el yodo tiene la primera energía de ionización más baja, la afinidad electrónica más baja, la electronegatividadmás baja y la reactividad más baja de los halógenos. [17]
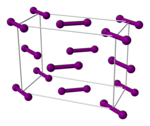
El enlace interhalógeno en diyodo es el más débil de todos los halógenos. Como tal, el 1% de una muestra de yodo gaseoso a presión atmosférica se disocia en átomos de yodo a 575 ° C. Se requieren temperaturas superiores a 750 ° C para que el flúor, el cloro y el bromo se disocien en una medida similar. La mayoría de los enlaces al yodo son más débiles que los enlaces análogos a los halógenos más ligeros. [17] El yodo gaseoso está compuesto de moléculas I 2 con una longitud de enlace I – I de 266.6 pm. El enlace I – I es uno de los enlaces individuales más largos que se conocen. Es incluso más largo (271.5 p.m.) en yodo cristalino ortorrómbico sólido , que tiene la misma estructura cristalina que el cloro y el bromo. (El registro lo mantiene el xenón vecino de yodo : la longitud del enlace Xe – Xe es 308.71 pm).[23] Como tal, dentro de la molécula de yodo, se producen interacciones electrónicas significativas con los dos vecinos más próximos a cada átomo, y estas interacciones dan lugar, en yodo en masa, a un aspecto brillante ypropiedades semiconductoras . [17] El yodo es un semiconductor bidimensional con un intervalo de banda de 1.3 eV (125 kJ / mol): es un semiconductor en el plano de sus capas cristalinas y un aislante en la dirección perpendicular. [17]
Isótopos [ editar ]
De los treinta y siete isótopos conocidos del yodo , solo uno ocurre en la naturaleza, el yodo-127. Los otros son radioactivos y tienen vidas medias demasiado cortas para ser primordiales . Como tal, el yodo es monoisotópicoy su peso atómico se conoce con gran precisión, ya que es una constante de la naturaleza. [17]
El isótopo radioactivo del yodo de mayor duración es el yodo-129 , que tiene una vida media de 15,7 millones de años, decayendo a través de la desintegración beta hasta el xenón estable -129. [24] Parte del yodo-129 se formó junto con el yodo-127 antes de la formación del Sistema Solar, pero hasta ahora se ha desintegrado por completo, lo que lo convierte en un radionúclido extinto que aún es útil para fechar la historia del Sistema Solar primitivo. o aguas subterráneas muy antiguas, debido a su movilidad en el medio ambiente. Su presencia anterior se puede determinar a partir de un exceso de su hija xenon-129. [25] [26] [27] [28] [29]Las trazas de yodo-129 todavía existen en la actualidad, ya que también es un núclido cosmogénico , formado a partir de la espalaciónde rayos cósmicos del xenón atmosférico: estas trazas constituyen 10 −14 a 10 −10 de todo el yodo terrestre. También se produce a partir de pruebas nucleares al aire libre y no es peligroso debido a su vida media increíblemente larga, la más larga de todas las fisiones. En el pico de las pruebas termonucleares en los años sesenta y setenta, el yodo-129 todavía constituía solo alrededor de 10 −7 de todo el yodo terrestre. [30] Losestados excitados de yodo-127 y yodo-129 se usan a menudo en la espectroscopia de Mössbauer . [17]
Los otros radioisótopos de yodo tienen vidas medias mucho más cortas, no más que días. [24] Algunos de ellos tienen aplicaciones médicas relacionadas con la glándula tiroides , donde se almacena y concentra el yodo que entra en el cuerpo. El yodo-123 tiene una vida media de trece horas y se descompone por la captura de electrones a teluro-123 , emitiendo radiación gamma ; se utiliza en imágenes de medicina nuclear , incluida la tomografía computarizada por emisión de fotón único (SPECT) y la tomografía computarizada de rayos X ( tomografía computarizada de rayos X). [31] El yodo-125 tiene una vida media de cincuenta y nueve días, decayendo por captura de electrones ateluro 125 y radiación gamma de baja energía; el segundo radioisótopo de yodo de mayor duración, tiene usos en ensayos biológicos , imágenes de medicina nuclear y en radioterapiacomo braquiterapia para tratar una serie de afecciones, como el cáncer de próstata , los melanomas uveales y los tumores cerebrales . [32] Finalmente, el yodo-131 , con una vida media de ocho días, la beta se desintegra a un estado excitado de xenón-131 estable que luego se convierte al estado fundamental emitiendo radiación gamma. Es un producto de fisión común.y por lo tanto está presente en niveles altos en lluvia radiactiva . Luego puede ser absorbido a través de alimentos contaminados y también se acumulará en la tiroides. A medida que se descompone, puede causar daño a la tiroides. El riesgo principal de la exposición a altos niveles de yodo-131 es la posibilidad de que ocurra un cáncer de tiroides radiogénico en la vida posterior. Otros riesgos incluyen la posibilidad de crecimientos no cancerosos y tiroiditis . [33]
El medio habitual de protección contra los efectos negativos del yodo-131 es mediante la saturación de la glándula tiroides con yodo-127 estable en forma de tabletas de yoduro de potasio , que se toman diariamente para una profilaxis óptima. [34] Sin embargo, el yodo-131 también se puede usar con fines medicinales en la radioterapia por esta misma razón, cuando se desea la destrucción del tejido después de la absorción de yodo por parte del tejido. [35] El yodo-131 también se usa como un trazador radioactivo . [36] [37] [38] [39]
Química y compuestos [ editar ]
| X | XX | HX | BX3 | Alx3 | CX4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| yo | 151 | 294 | 272 | 285 | 239 |
Aunque es el menos reactivo de los halógenos, el yodo sigue siendo uno de los elementos más reactivos. Por ejemplo, mientras que el gas cloro halogenará monóxido de carbono , óxido nítrico y dióxido de azufre (a fosgeno , cloruro de nitrosilo y cloruro de sulfurilo, respectivamente), el yodo no lo hará. Además, la yodación de metales tiende a producir estados de oxidación más bajos que la cloración o bromación; por ejemplo, el renio metálico reacciona con el cloro para formar hexacloruro de renio , pero con el bromo solo forma pentabromuro de renio y el yodo puede lograr solo tetraioduro de renio .[17] De la misma manera, sin embargo, dado que el yodo tiene la energía de ionización más baja entre los halógenos y es el más fácil de oxidar, tiene una química catiónica más significativa y sus estados de oxidación más altos son bastante más estables que los de bromo y Cloro, por ejemplo en heptafluoruro de yodo . [19]
Yoduro de Hidrógeno [ editar ]
El compuesto más simple de yodo es el yoduro de hidrógeno , HI. Es un gas incoloro que reacciona con el oxígeno para dar agua y yodo. Aunque es útil en las reacciones de yodación en el laboratorio, no tiene usos industriales a gran escala, a diferencia de los otros haluros de hidrógeno. Comercialmente, generalmente se hace al reaccionar yodo con sulfuro de hidrógeno o hidracina : [40]
- 2 I 2 + N 2 H 4 H 2 O⟶ 4 HI + N 2
A temperatura ambiente, es un gas incoloro, como todos los haluros de hidrógeno , excepto el fluoruro de hidrógeno , ya que el hidrógeno no puede formar enlaces de hidrógeno fuertes al átomo de yodo grande y solo ligeramente electronegativo. Se derrite a −51.0 ° C y hierve a −35.1 ° C. Es un compuesto endotérmico que puede disociarse exotérmicamente a temperatura ambiente, aunque el proceso es muy lento a menos que esté presente un catalizador : la reacción entre hidrógeno y yodo a temperatura ambiente para dar yoduro de hidrógeno no se completa. La energía de disociación del enlace H – I es también la más pequeña de los haluros de hidrógeno, a 295 kJ / mol. [41]
El yoduro de hidrógeno acuoso se conoce como ácido yodhídrico , que es un ácido fuerte. El yoduro de hidrógeno es excepcionalmente soluble en agua: un litro de agua disolverá 425 litros de yoduro de hidrógeno, y la solución saturada tiene solo cuatro moléculas de agua por molécula de yoduro de hidrógeno. [42] El llamado ácido yodhídrico "concentrado" comercial generalmente contiene 48-57% de HI en masa; la solución forma un azeótropo con un punto de ebullición de 126.7 ° C a 56.7 g de HI por 100 g de solución. Por lo tanto, el ácido yodhídrico no puede concentrarse más allá de este punto por evaporación del agua. [41]
A diferencia de fluoruro de hidrógeno , anhidro yoduro de hidrógeno líquido es difícil de trabajar como disolvente, debido a que su punto de ebullición es bajo, tiene una pequeña gama líquido, su constante dieléctrica es baja y no se disocia apreciablemente en H 2 I + y HI -
2 iones: estos últimos, en cualquier caso, son mucho menos estables que los iones bifluoruro ( HF -
2 ) debido a la unión de hidrógeno muy débil entre el hidrógeno y el yodo, aunque sus sales tienen cationes muy grandes y débilmente polarizadores, como Cs + y NR +
4 (R = Me ,Et , Bu n) todavía puede estar aislado. El yoduro de hidrógeno anhidro es un disolvente pobre, capaz de disolver solo compuestos de moléculas pequeñas como el cloruro de nitrosilo y el fenol , o sales con muy poca energía de la red como los haluros de tetraalquilamonio. [41]
2 iones: estos últimos, en cualquier caso, son mucho menos estables que los iones bifluoruro ( HF -
2 ) debido a la unión de hidrógeno muy débil entre el hidrógeno y el yodo, aunque sus sales tienen cationes muy grandes y débilmente polarizadores, como Cs + y NR +
4 (R = Me ,Et , Bu n) todavía puede estar aislado. El yoduro de hidrógeno anhidro es un disolvente pobre, capaz de disolver solo compuestos de moléculas pequeñas como el cloruro de nitrosilo y el fenol , o sales con muy poca energía de la red como los haluros de tetraalquilamonio. [41]
Otros yoduros binarios [ editar ]
Casi todos los elementos en la tabla periódica forman yoduros binarios. Las excepciones están decididamente en la minoría y se derivan en cada caso de una de las tres causas: inercia extrema y renuencia a participar en reacciones químicas (los gases nobles ); la extrema inestabilidad nuclear dificulta la investigación química antes de la descomposición y la transmutación (muchos de los elementos más pesados más allá del bismuto ); y que tiene una electronegatividad mayor que la del yodo ( oxígeno , nitrógeno y los tres primeros halógenos), de modo que los compuestos binarios resultantes no son formalmente yoduros, sino más bien óxidos, nitruros o haluros de yodo. (No obstante, el triyoduro de nitrógeno se denomina yoduro ya que es análogo a los otros trihaluros de nitrógeno).[43]
Dado el gran tamaño del anión yoduro y el débil poder oxidante del yodo, los estados de oxidación elevados son difíciles de lograr en los yoduros binarios, siendo el máximo conocido en los pentayodidos de niobio , tántalo y protactinio . Los yoduros se pueden hacer por reacción de un elemento o su óxido, hidróxido o carbonato con ácido yodhídrico, y luego se deshidratan con temperaturas ligeramente altas combinadas con gas de yoduro de hidrógeno a baja presión o anhidro. Estos métodos funcionan mejor cuando el producto de yoduro es estable a la hidrólisis; de lo contrario, las posibilidades incluyen la yodación oxidativa a alta temperatura del elemento con yodo o yoduro de hidrógeno, la yodación a alta temperatura de un óxido metálico u otro haluro por yodo, un haluro metálico volátil,Tetraioduro de carbono o un yoduro orgánico. Por ejemplo, el óxido de molibdeno (IV)reacciona con yoduro de aluminio (III) a 230 ° C para dar yoduro de molibdeno (II) . A continuación se proporciona un ejemplo que involucra el intercambio de halógenos, que involucra la reacción del cloruro de tantalio (V) con el exceso de yoduro de aluminio (III) a 400 ° C para obtener yoduro de tantalio (V) : [43]
Los yoduros inferiores pueden producirse por descomposición térmica o desproporción, o reduciendo el yoduro superior con hidrógeno o un metal, por ejemplo: [43]
La mayoría de los yoduros de los metales de pre-transición (grupos 1, 2 y 3, junto con los lantánidos y actínidosen los estados de oxidación +2 y +3) son en su mayoría iónicos, mientras que los no metales tienden a formar yoduros moleculares covalentes, al igual que Metales en estados de alta oxidación desde +3 y superiores. Yoduros iónicos Los MI n tienden a tener los puntos de fusión y ebullición más bajos entre los haluros MX ndel mismo elemento, porque las fuerzas electrostáticas de atracción entre los cationes y los aniones son más débiles para el anión yoduro grande. En contraste, los yoduros covalentes tienden a tener los más altos puntos de fusión y ebullición entre los haluros del mismo elemento, ya que el yodo es el más polarizable de los halógenos y, al tener la mayoría de los electrones entre ellos, puede contribuir más a las fuerzas de van der Waals. . Naturalmente, abundan las excepciones en los yoduros intermedios donde una tendencia da paso a la otra. De manera similar, las solubilidades en agua de yoduros predominantemente iónicos (por ejemplo, potasio y calcio ) son las más altas entre los haluros iónicos de ese elemento, mientras que las de yoduros covalentes (por ejemplo, la plata ) son las más bajas de ese elemento. En particular,El yoduro de plata es muy insoluble en agua y su formación se utiliza a menudo como una prueba cualitativa para el yodo. [43]
Haluros de yodo [ editar ]
Los halógenos forman muchos compuestos halogenados bivalentes , diamagnéticos , con estequiometrías XY, XY 3 , XY 5 y XY 7 (donde X es más pesado que Y), y el yodo no es una excepción. El yodo forma los tres posibles inhaladores diatómicos, un trifluoruro y tricloruro, así como un pentafluoruro y, excepcionalmente entre los halógenos, un heptafluoruro. También se caracterizan numerosos derivados catiónicos y aniónicos, como los compuestos de color rojo vino o naranja brillante de ICl +2 y los compuestos de color marrón oscuro o negro violáceo de I 2 Cl + . Aparte de estos, también se conocen algunos pseudohaluros , como
yoduro de cianógeno(ICN), yodo tiocianato (ISCN), y yodo azida (IN 3 ). [44]
yoduro de cianógeno(ICN), yodo tiocianato (ISCN), y yodo azida (IN 3 ). [44]
El monofluoruro de yodo (IF) es inestable a temperatura ambiente y se desproporciona muy fácilmente e irreversiblemente a yodo y pentafluoruro de yodo , y por lo tanto no se puede obtener puro. Se puede sintetizar a partir de la reacción de yodo con gas fluorado en triclorofluorometano a -45 ° C, con trifluoruro de yodo en triclorofluorometano a -78 ° C, o con fluoruro de plata (I) a 0 ° C. [44] Porotra parte, el monocloruro de yodo (ICl) y el monobromuro de yodo (IBr) son moderadamente estables. El primero, un compuesto volátil rojo marrón, fue descubierto independientemente por Joseph Louis Gay-Lussac y Humphry Davy.En 1813-4, no mucho después de los descubrimientos de cloro y yodo, imita el bromo halógeno intermedio tan bien que Justus von Liebig fue confundido para confundir el bromo (que había encontrado) con monocloruro de yodo. El monocloruro de yodo y el monobromuro de yodo se pueden preparar simplemente haciendo reaccionar el yodo con cloro o bromo a temperatura ambiente y purificando por cristalización fraccionada . Ambos son bastante reactivos y atacan incluso el platino y el oro , aunque no el boro , el carbono , el cadmio , el plomo , el circonio , el niobio , el molibdeno y el tungsteno.. Su reacción con compuestos orgánicos depende de las condiciones. El vapor de cloruro de yodo tiende a clorar el fenol y el ácido salicíclico , ya que cuando el cloruro de yodo sufre una disociación homolítica, se producen cloro y yodo y el primero es más reactivo. Sin embargo, el cloruro de yodo en la solución de tetraclorometano resulta en la yodación como reacción principal, ya que ahora se produce la fisión heterolítica del enlace I-Cl y el I + ataca al fenol como un electrófilo. Sin embargo, el monobromuro de yodo tiende a bromar fenol incluso en solución de tetraclorometano porque tiende a disociarse en sus elementos en solución, y el bromo es más reactivo que el yodo. [44] Cuando son líquidos, el monocloruro de yodo y el monobromuro de yodo se disocian enyo
2 X+
y IX -
2 aniones (X = Cl, Br); por lo tanto, son conductores importantes de electricidad y pueden usarse como solventes ionizantes. [44]
2 X+
y IX -
2 aniones (X = Cl, Br); por lo tanto, son conductores importantes de electricidad y pueden usarse como solventes ionizantes. [44]
Trifluoruro de yodo (IF 3 ) es un sólido de color amarillo inestable que se descompone por encima de -28 ° C. Por eso es poco conocido. Es difícil de producir porque el gas flúor tendería a oxidar el yodo hasta el pentafluoruro; La reacción a baja temperatura con difluoruro de xenón es necesaria. El tricloruro de yodo , que existe en estado sólido como el dímero plano I 2 Cl 6 , es un sólido amarillo brillante, sintetizado por reacción de yodo con cloro líquido a -80 ° C; es necesario tener precaución durante la purificación porque se disocia fácilmente al monocloruro de yodo y al cloro y, por lo tanto, puede actuar como un agente clorante fuerte. El tricloruro de yodo líquido conduce la electricidad, lo que posiblemente indica una disociación aICl +
2 y ICl -
4 iones. [45]
2 y ICl -
4 iones. [45]
El pentafluoruro de yodo (IF 5 ), un líquido volátil e incoloro, es el fluoruro de yodo más termodinámicamente estable, y puede producirse haciendo reaccionar el yodo con gas fluorado a temperatura ambiente. Es un agente fluorante, pero es lo suficientemente suave para almacenar en aparatos de vidrio. De nuevo, en el estado líquido está presente una ligera conductividad eléctrica debido a la disociación a IF +
4 e IF -
6 . El heptafluoruro de yodo bipiramidal pentagonal (IF 7 ) es un agente fluorante extremadamente poderoso, solo por detrás del trifluoruro de cloro , el pentafluoruro de cloro y el pentafluoruro de bromoentre los interhalógenos: reacciona con casi todos los elementos, incluso a bajas temperaturas, fluorina el vidrio de Pyrex para formar oxifluoruro de yodo (VII) (IOF 5 ) y enciende el monóxido de carbono.
4 e IF -
6 . El heptafluoruro de yodo bipiramidal pentagonal (IF 7 ) es un agente fluorante extremadamente poderoso, solo por detrás del trifluoruro de cloro , el pentafluoruro de cloro y el pentafluoruro de bromoentre los interhalógenos: reacciona con casi todos los elementos, incluso a bajas temperaturas, fluorina el vidrio de Pyrex para formar oxifluoruro de yodo (VII) (IOF 5 ) y enciende el monóxido de carbono.



![{\ displaystyle {\ ce {TaI5 {} + Ta -> [{\ text {gradiente térmico}}] [{\ ce {630 ^ {\ circ} C \ -> \ 575 ^ {\ circ} C}}] Ta6I14}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2bccb303062c4ab95661541d583e04d60a434c25)

No hay comentarios:
Publicar un comentario